Acetammide: proprietà, produzione e applicazioni

Cos’è l’acetamide?
L’acetamide, nota anche come etanamide o ammide dell’acido acetico, è un composto organico con formula chimica C2H5NO. È un solido bianco, inodore e igroscopico formato da acido acetico e ammoniaca. L’acetamide è presente in natura nelle radici delle barbabietole da zucchero e nelle discariche di rifiuti delle miniere di carbone come sottoprodotto minore della degradazione di materiali organici.
Sommario
1. Proprietà fisiche dell’acetamide
L’acetamide pura ha un sapore amaro ed è inodore. Un caratteristico odore di topo è attribuito a tracce di impurità, probabilmente derivanti dall’acetonitrile. L’acetamide si presenta in due forme cristalline: una forma trigonale stabile e una forma ortorombica metastabile. È molto solubile in acqua, etanolo e cloroformio, glicerina, benzene caldo e leggermente solubile in etere dietilico.
La Tabella 1 elenca le principali proprietà fisiche dell’acetamide.
| Proprietà | Valore |
|---|---|
| Numero di registro CAS | 60-35-5 |
| Formula molecolare | C2H5NO |
| Massa molare | 59,07 g·mol−1 |
| Punto di fusione | 81–82 °C |
| Punto di fusione (trigonale) | 80,0–80,1 °C |
| Punto triplo | 353,33 K |
| Punto di ebollizione (1 atm) | ≈221 °C |
| Densità (20 °C) | ≈1,16 g/cm3 |
| Densità di fusione a 85°C | 0,9986 g·mL−1 |
| Calore di fusione (ΔHm) | 264 kJ·kg−1 |
| Costante dielettrica | 59 |
| Momento di dipolo | 12,41 × 10−30 C·m |
| Pressione di vapore a 272 K | 10 kPa |
| Pressione di vapore a 278 K | 20 kPa |
| Pressione di vapore a 281 K | 30 kPa |
| Pressione di vapore a 284 K | 40 kPa |
| Pressione di vapore a 285 K | 50 kPa |
| Pressione di vapore a 287 K | 60 kPa |
| Pressione di vapore a 288 K | 70 kPa |
| Pressione di vapore a 290 K | 80 kPa |
| Pressione di vapore a 291 K | 90 kPa |
| Pressione di vapore a 292 K | 100 kPa |
2. Proprietà chimiche dell’acetamide
L’acetamide è un’ammide alifatica semplice e presenta proprietà caratteristiche del gruppo funzionale ammidico.
L’acetamide mostra un comportamento anfotero quando disciolta in acqua. L’idrolisi in acqua neutra avviene solo lentamente, ma in presenza di acidi o basi forti reagisce istantaneamente per produrre acido acetico e ammoniaca.
La costante di autodissociazione dell’acetamide è di circa 3,2 × 10-11 a 94 °C, il che dimostra una bassa tendenza all’autoionizzazione in condizioni termiche.
L’acetamide reagisce con acidi minerali per formare complessi solidi. Sali di bromuro di idrogeno, cloruro di idrogeno e acido nitrico con acetamide sono stati isolati e caratterizzati.
La fase fusa dell’acetammide viene utilizzata per sciogliere sali metallici di cui sono state valutate conduttività, stabilità e idoneità all’elettrodeposizione.
3. Produzione dell’acetammide
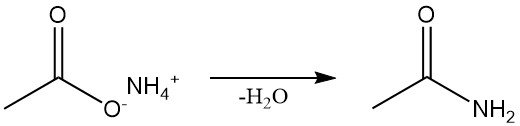
L’acetammide si ottiene attraverso diversi metodi di sintesi. Viene prodotta industrialmente mediante disidratazione continua dell’acetato di ammonio, che è anche il metodo standard di laboratorio.
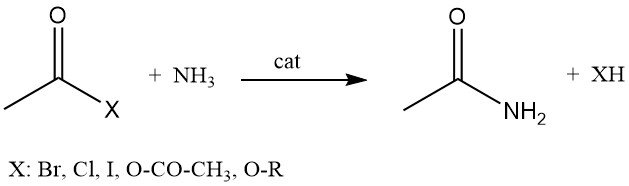
L’acetammide può essere prodotta anche dalla reazione di alogenuri di acetile, anidride acetica o acetati di alchile con ammoniaca.
Un metodo alternativo per la produzione di acetammide è l’idratazione dell’acetonitrile in presenza di catalizzatori acidi o basici. Questo processo è ampiamente utilizzato perché l’acetonitrile viene prodotto come sottoprodotto nella produzione di acrilonitrile.
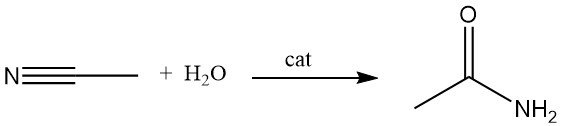
L’idratazione dell’acetonitrile catalizzata dal rame può raggiungere efficienze di conversione fino all’83%. Alcuni microrganismi sono anche in grado di catalizzare questa reazione a temperatura ambiente.
4. Usi dell’acetamide
L’acetamide è utilizzata come solvente e come plastificante. Ha un’ampia gamma di applicazioni in diversi settori.
L’acetamide inibisce l’accumulo di acidi in inchiostri da stampa, lacche, esplosivi e profumi. È utilizzata come idratante delicato e come agente ammorbidente per cuoio, tessuti, carta e alcune materie plastiche.
L’acetamide è anche impiegata come intermedio nella sintesi di prodotti farmaceutici, pesticidi e antiossidanti per materie plastiche. I derivati dell’acetamide, comprese le tiouree contenenti acetamide sostituita, sono stati studiati per l’attività antivirale contro i virus dell’herpes.
L’acetamide è utilizzata come plastificante e stabilizzante nella produzione di polimeri. È stato studiato come agente crioprotettivo e come componente di lubrificanti e formulazioni ignifughe.
Alcuni derivati dell’acetamide vengono utilizzati come modificatori del comportamento alimentare in studi agricoli.
Nella ricerca di laboratorio, l’acetamide viene spesso utilizzata come composto modello per studiare le proprietà strutturali e di legame a idrogeno delle ammidi.
5. Tossicologia dell’acetamide
L’acetamide è stata utilizzata come fonte di azoto non proteico nei ruminanti, come ovini e bovini da latte. Livelli dietetici di circa il 2-3% sembrano non tossici. Tamponare la dieta con acidi bibasici consente un apporto maggiore, eliminando l’ammoniaca rilasciata durante la digestione.
L’Agenzia Internazionale per la Ricerca sul Cancro (IARC) classifica l’acetamide come possibile cancerogeno per l’uomo (Gruppo 2B).
L’esposizione orale cronica nei ratti ha dimostrato epatocarcinogenicità: la somministrazione per un anno di acetamide al 2,36% nella dieta ha provocato il cancro al fegato. Ulteriori studi hanno rivelato effetti epatotossici ed emopoietici.
Il meccanismo preciso della tossicità dell’acetamide rimane poco chiaro. Il suo profilo differisce da quello della dimetilacetamide e sembra correlato alla formazione di idrossilammina dal suo metabolita primario, l’acido acetoidrossamico.
L’acetamide non mostra tossicità per lo sviluppo. Studi riproduttivi su roditori non hanno indicato alterazioni della spermatogenesi, alterazioni ormonali o danni agli organi riproduttivi accessori.
Nei topi, la somministrazione orale di acetamide ha prodotto tumori epatici benigni e maligni. I topi maschi hanno anche mostrato una maggiore incidenza di linfomi maligni. Nel complesso, questi risultati supportano la classificazione dell’acetamide come epatocarcinogeno nei roditori con possibile potenziale cancerogeno nell’uomo.
Riferimenti bibliografici
1. Wagner, F.S., Jr. (2002). Acetamide. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a02.pub2
2. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
3. Mohammadi, S.; Foroumadi, A. Acetamide. In *Encyclopedia of Toxicology*, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 39–42. DOI: 10.1016/B978-0-12-824315-2.01089-7
