Wat is isopropanol?
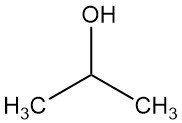
Isopropylalcohol, ook bekend als isopropanol of 2-propanol, is de eenvoudigste secundaire alcohol met de chemische formule C3H7OH. Het is een kleurloze, vluchtige en ontvlambare vloeistof met een licht bittere smaak en een zwakke geur die lijkt op een mengsel van ethanol en aceton.
Isopropanol komt in de natuur voor in ruwe foezeloliën en als fermentatie en afbraakproducten van diverse groenten. Het wordt beschouwd als de eerste petrochemisch verkregen alcohol en staat onder de lagere alcoholen (C1–C5) op de derde plaats in de wereldwijde productie, na methanol en ethanol.
Inhoudsopgave
1. Fysische eigenschappen van isopropanol
Isopropylalcohol (2-propanol) is een secundaire alcohol die volledig mengbaar is met water en gemakkelijk oplosbaar is in een breed scala aan gangbare organische oplosmiddelen, waaronder ethers, esters, ketonen, zuren en andere alcoholen.
De oplosbaarheid van isopropanol in water neemt af in aanwezigheid van opgeloste zouten, en de toevoeging van zouten zoals natriumchloride of natriumsulfaat induceert fasescheiding, waardoor een onmengbare organische laag ontstaat. Deze eigenschap wordt benut bij de extractie van polaire verbindingen uit waterige oplossingen.
De fysische eigenschappen van isopropylalcohol worden beïnvloed door de polaire hydroxylgroep (-OH) en de secundaire alcoholstructuur. Het kook- en vlampunt zijn lager dan dat van n-propanol, terwijl de dampspanning en het vriespunt hoger zijn.
Tabel 1 geeft de fysische eigenschappen van watervrije isopropylalcohol weer, evenals de azeotrope samenstelling met water (91 vol%).
| Eigenschap | Watervrij | 91 Vol.% |
|---|---|---|
| Molecuulgewicht | 60,10 | |
| Kookpunt, bij 101,3 kPa, °C | 82,3 | 80,4 |
| Vriespunt, °C | -88,5 | -50,0 |
| Soortelijk gewicht, 20/20 | 0,7864 | 0,8183 |
| Dichtheid, bij 20 °C, g/cm3 | 0,7854 | 0,8173 |
| Oppervlaktespanning, bij 20 °C, mN/m(= dyn/cm) | 21,32 | 21,40 |
| Soortelijke warmte, vloeistof bij 20 °C, J/(kg·K) | 2510,4 | |
| brekingsindex | 1,3772 | 1,3769 |
| verbrandingswarmte, bij 25 °C, kJ/mol | 2005,8 | |
| latente verdampingswarmte, bij 101,3 kPa, kJ/mol | 39,8 | |
| dampspanning, bij 20 °C, kPa | 4,4 | 4,5 |
| kritische temperatuur, °C | 235,2 | |
| Kritische druk, bij 20 °C, kPa | 4764 | |
| Viscositeit, mPa·s(= cP) bij 0 °C | 4,6 | |
| Viscositeit, mPa·s(= cP) bij 20 °C | 2,4 | 2,1 |
| Viscositeit, mPa·s(= cP) bij 40 °C | 1,4 | |
| Ontvlambaarheidsgrens in lucht, vol.% | Onder: 2,5 Boven: 12 |
|
| Vlampunt, °C (open beker) | 17,2 | 21,7 |
| Vlampunt, °C (gesloten beker) | 11,7 | 18,3 |
| Zelfontbrandingstemperatuur, °C | 399 |
Commerciële soorten isopropanol in de Verenigde Staten bestaan voornamelijk uit watervrije isopropylalcohol en een waterige azeotroop met 91 vol%, bekend als het constant kokende mengsel. Formuleringen met ontsmettingsalcohol bevatten doorgaans 70% of meer isopropylalcohol in water.
Isopropylalcohol vormt ook azeotropen met diverse verbindingen, waaronder koolwaterstoffen, esters, halogeenkoolwaterstoffen, aminen, ketonen en aromatische koolwaterstoffen. Het vormt geen binaire azeotropen met aceton, ethanol, ethylbenzeen, hexylamine of methylisobutylketon, maar het kan wel ternaire azeotrope systemen vormen met sommige van deze verbindingen.
Voorbeelden van enkele binaire azeotropen van isopropylalcohol staan in tabel 2.
| Component | Kookpunt, °C | Kookpunt van de azeotroop, °C | Samenstelling isopropylalcohol, gew.% |
|---|---|---|---|
| water | 100 | 80,3 | 87,4 |
| tolueen | 110,6 | 80,6 | 69 |
| methylpropionaat | 79,6 | 77 | 28 |
| methylethylketon | 79,6 | 77,9 | 32 |
| ethylacetaat | 77,05 | 75,9 | 25 |
| 2-chloorbutaan | 68,25 | 64 | 18 |
| hexaan | 68,9 | 62,7 | 23 |
| cyclohexaan | 80,8 | 68,6 | 33 |
| butylamine | 77,8 | 84,7 | 60 |
| di-isopropylether | 69 | 66,2 | 16,3 |
2. Chemische reacties van isopropanol
De chemische eigenschappen van isopropylalcohol worden bepaald door de aanwezigheid van een secundaire hydroxylgroep. De reactiviteit is kenmerkend voor secundaire alcoholen en is over het algemeen hoger aan de hydroxylgroep in vergelijking met primaire alcoholen zoals n-propyl- of ethylalcohol. De meeste reacties omvatten splitsing van de C-OH- of de O-H-binding.
Isopropylalcohol ondergaat een breed scala aan transformaties, waaronder dehydrogenering, oxidatie, verestering, verethering, aminering en halogenering. Industrieel belangrijke voorbeelden zijn de bereiding van aluminiumisopropoxide en isopropylhalogeniden.
Aluminiumisopropoxide wordt in kwantitatieve opbrengst geproduceerd door isopropylalcohol te refluxen met aluminiummetaal in aanwezigheid van katalytische hoeveelheden kwikchloride:
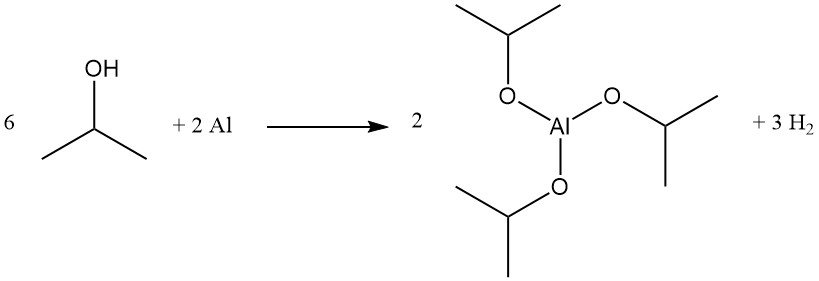
Deze verbinding is een effectief Meerwein-Ponndorf-Verley-reductiemiddel voor bepaalde esteruitwisselings- en carbonylreductiereacties en wordt gebruikt als precursor voor aluminiumglycinaat, een buffer.
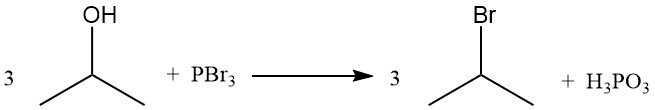
Isopropylhalogeniden, zoals isopropylbromide, worden verkregen door de hydroxylgroep te verdringen door reactie met waterstofhalogeniden. Het terugvloeien van isopropylalcohol met waterstofbromide levert isopropylbromide en water op:
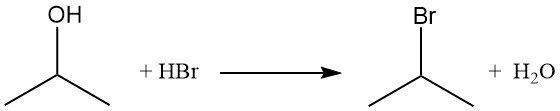
De volgorde van reactiviteit met waterstofhalogeniden is HI > HBr > HCl. De reactie met zoutzuur tot isopropylchloride wordt gekatalyseerd door de aanwezigheid van zinkchloride.
Isopropylalcohol kan worden gedeprotoneerd tot isopropoxidezouten, die veel worden gebruikt als sterke, niet-nucleofiele basen in de organische synthese.
In katalytische transferhydrogeneringsreacties wordt het gebruikt als terminale reductiemiddel voor de reductie van aldehyden, ketonen en andere functionele groepen. Tijdens deze reacties wordt 2-propanol geoxideerd tot aceton.
Dit proces is omkeerbaar en langdurig contact tussen het product en de katalysator kan de enantiozuiverheid bij asymmetrische reducties verlagen. Het evenwicht kan worden verschoven naar productvorming door een overmaat isopropanol te gebruiken, door aceton te verwijderen door destillatie, of door het gereduceerde product uit het reactiemedium te scheiden.
2.1. Dehydrogenering van isopropanol
Dehydrogenering van isopropylalcohol is een belangrijke industriële reactie voor de productie van aceton. Vóór de grootschalige coproductie van aceton in fenolproductieprocessen was het de belangrijkste commerciële methode voor de synthese van aceton.
Het proces is endotherm, met een warmtebehoefte van 66,5 kJ/mol bij 327 °C. Het wordt uitgevoerd in de dampfase met temperaturen van 300-500 °C en een gematigde druk van ongeveer 207 kPa, wat resulteert in een selectiviteit van circa 90% voor aceton en een omzetting van 2-propanol van 98%.
Veelgebruikte katalysatoren zijn onder andere koper, chroom, zink en nikkel, afzonderlijk toegepast, als oxiden of in gemengde vormen op een inerte ondergrond. Een representatieve reactie is:

De selectiviteit voor aceton is hoog, maar er worden kleine hoeveelheden bijproducten gevormd via dehydratatie, condensatie of oxidatie. Deze omvatten propyleen, di-isopropylether, mesityloxide, aceetaldehyde en propionaldehyde.
De reactie kan ook in de vloeistoffase plaatsvinden.
Dehydrogenering van isopropylalcohol kan ook oxidatief worden uitgevoerd met behulp van zilver- of koperkatalysatoren bij temperaturen van 400-600 °C. Gepatenteerde processen beschrijven oxidatieve dehydrogenering in de dampfase voor de productie van gemengde ketonen, waaronder aceton, methylisobutylketon en hogere ketonen.
In één voorbeeld produceert de dehydrogenering in de dampfase van een azeotropisch mengsel van 2-propanol en water over een koperkatalysator bij 220 °C een mengsel dat aceton (52,4%), ongereageerde 2-propanol (11,4%), methylisobutylketon (21,6%), di-isobutylketon (6,5%) en 4-methyl-2-pentanol (2,2%) bevat.
2.2. Oxidatie van isopropanol
Isopropylalcohol ondergaat katalytische oxidatie met lucht of zuurstof bij 400–600 °C om aceton en water te produceren:
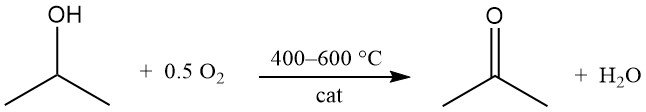
Katalysatoren zijn vergelijkbaar met die welke worden gebruikt in dehydrogeneringsprocessen. In tegenstelling tot dehydrogenering is de oxidatiereactie sterk exotherm en komt er 180 kJ/mol vrij bij 295 °C. Zorgvuldige controle van de procesomstandigheden is noodzakelijk om de vorming van bijproducten te beperken, met name via dehydratatie.
Oxidatie en dehydrogenering kunnen gelijktijdig worden uitgevoerd met geschikte katalysator- en bedrijfsomstandigheden, hoewel de industriële toepassing van oxidatie voor de productie van aceton beperkt is in vergelijking met dehydrogenering.
Gedeeltelijke oxidatie van isopropylalcohol kan in de vloeistoffase zonder katalysator worden uitgevoerd om waterstofperoxide en aceton te produceren:
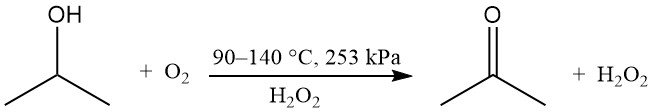
Zuurstof of lucht wordt gebruikt met een peroxide-initiator, zoals waterstofperoxide. De reactiesnelheid wordt beïnvloed door de concentratie van het bijproduct azijnzuur. De theoretische gewichtsverhouding van aceton tot waterstofperoxide is 1,7. Deze methode wordt gebruikt wanneer waterstofperoxide het gewenste product is, terwijl aceton en ongereageerde isopropanol worden gerecycled.
In het proces van Shell wordt de op deze manier geproduceerde waterstofperoxide gebruikt om allylalcohol te oxideren tot acroleïne, terwijl het in het Burmah Oil-proces wordt omgezet in perazijnzuur.
2-propanol reageert ook met α,β-onverzadigde aldehyden of ketonen boven metaaloxidekatalysatoren bij verhoogde temperaturen. In een Shell-proces voor de productie van allylalcohol wordt een dampfasemengsel van isopropanol en acroleïne bij 400 °C over ongecalcineerd magnesiumoxide en zinkoxide geleid om ongeveer 77% allylalcohol op basis van acroleïne te verkrijgen.
2.3. Verestering van isopropanol
Isopropylalcohol ondergaat een verestering met carbonzuren in aanwezigheid van zure katalysatoren zoals p-tolueensulfonzuur. De reactie vindt doorgaans plaats bij 100-160 °C en atmosferische druk, waarbij een overmaat alcohol wordt gebruikt om het evenwicht te bevorderen en estervorming te bewerkstelligen.
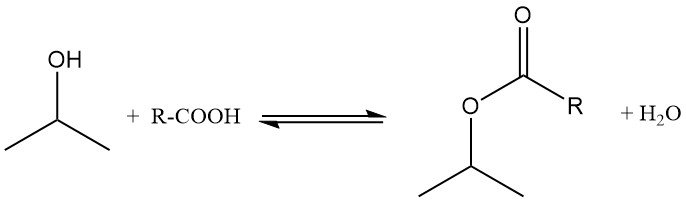
Het tijdens de reactie gevormde water wordt als azeotroop verwijderd om het evenwicht te verschuiven. Overtollig isopropanol wordt gedestilleerd en gerecycled, en de esteropbrengsten benaderen kwantitatieve niveaus. Zo wordt isopropylacetaat bereid uit isopropanol en azijnzuur in aanwezigheid van zwavelzuur, waarbij tolueen als azeotroop wordt gebruikt.
Kinetische studies zijn uitgevoerd naar de verestering van isopropanol met verschillende organische zuren met behulp van gesulfoneerde kationenwisselaarharsen. Reactie met myristinezuur levert isopropylmyristaat op, een verzachtend middel en smeermiddel dat wordt gebruikt in cosmetica en topische farmaceutische producten. Een geleiachtige vorm van deze ester wordt op de markt gebracht als Estergel.
Isopropylalcohol reageert met koolstofdisulfide om xanthaatesters te produceren. Natriumisopropylxanthaat wordt gebruikt in minerale flotatieprocessen en als herbicide in de bonen- en erwtenteelt.
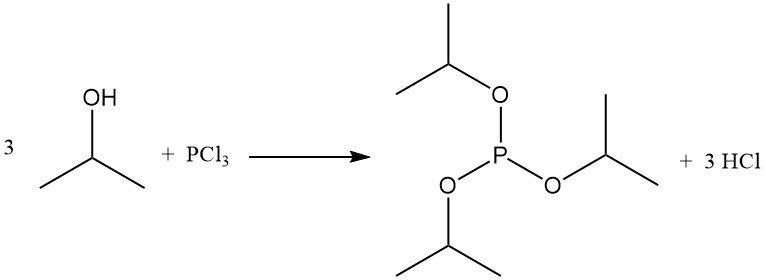
De reactie van 2-propanol met fosforhalogeniden vormt fosfietesters. Tri-isopropylfosfiet wordt verkregen uit fosfortrichloride en isopropylalcohol bij lage temperaturen in aanwezigheid van een zuurvanger zoals pyridine:
Titaantetrachloride reageert met isopropanol tot tetra(isopropyl)titanaat, een commerciële polymerisatiekatalysator.
Isopropylnitraat wordt bereid door de reactie van isopropanol met salpeterzuur, waarbij de reactanten afzonderlijk in een distilleerketel worden gebracht en het product continu door destillatie wordt verwijderd.
Isopropylnitraat wordt gebruikt als startbrandstof voor motoren en in explosieve formuleringen. De nitrietester, isopropylnitriet, wordt gevormd uit isopropanol en nitrosylchloride of salpeterigzuur bij omgevingstemperatuur en dient als brandstof voor straalmotoren.
2.4. Verethering van isopropanol
Isopropylalcohol kan in de vloeibare fase worden gedehydrateerd boven sterk zure katalysatoren, zoals zwavelzuur, of in de dampfase boven zuur aluminiumoxide, om diisopropylether (DIPE) of propyleen te produceren.
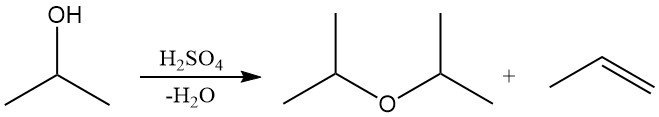
De selectiviteit voor DIPE of propyleen hangt af van de keuze van de katalysator en de reactieomstandigheden. Industrieel wordt DIPE voornamelijk verkregen als bijproduct tijdens de productie van isopropylalcohol. Overtollig DIPE wordt vaak gerecycled over zure katalysatoren om isopropylalcohol te regenereren via hydratatie. DIPE wordt in beperkte hoeveelheden gebruikt als oplosmiddel en in industriële extractieprocessen.
De Amerikaanse Clean Air Act uit 1990, die het gebruik van oxygenaten in benzine verplicht stelde, creëerde een potentiële vraag naar DIPE als brandstofoxygenaat. DIPE kan worden gesynthetiseerd door isopropylalcohol te laten reageren met propyleen over zure ionenwisselaarkatalysatoren bij lage temperaturen.
Glycolethers kunnen ook worden bereid uit isopropylalcohol door reactie met olefineoxiden zoals ethyleenoxide of propyleenoxide. Een reactie met ethyleenoxide levert bijvoorbeeld 2-isopropoxyethanol op (commercieel bekend als isopropylcellosolve), meestal gekatalyseerd door alkalihydroxiden.
Secundaire alkoxylering van het uitgangsproduct met extra olefineoxide vormt hogere gealkoxyleerde derivaten (oligomeren). Deze concurrerende reactie is vooral belangrijk bij gebruik van ethyleenoxide, omdat de geproduceerde terminale primaire hydroxygroep reactiever is.
Glycolethers afgeleid van isopropylalcohol worden gebruikt als oplosmiddelen in lakken, email en watergedragen coatings om de glans, vloei en filmeigenschappen te verbeteren.
2.5. Aminering van isopropanol
Isopropylalcohol ondergaat aminering door ammonolyse met dehydratatiekatalysatoren of door reductieve ammonolyse met hydrogeneringskatalysatoren. Beide methoden produceren isopropylamine en diisopropylamine. Triisopropylamine wordt slechts in verwaarloosbare hoeveelheden gevormd.
De verhouding van mono- tot diisopropylamine hangt af van de molaire verhouding van isopropylalcohol tot ammoniak, die doorgaans varieert van 2:1 tot 5:1.
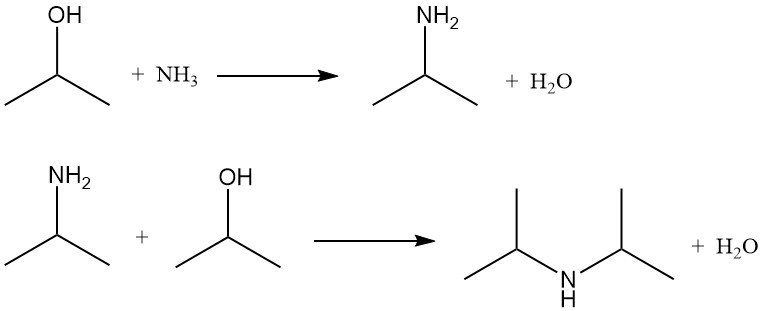
Bij reductieve ammonolyse is waterstof aanwezig om de levensduur van de katalysator te verlengen door cokesvorming en teervorming te voorkomen, maar het wordt niet significant verbruikt. De reacties worden normaal gesproken uitgevoerd bij 150-250 °C en 790-2860 kPa in een reactor met een vast bed, met katalysatoren bestaande uit koper, chroom of nikkel op aluminiumoxide.
De omzetting van isopropylalcohol bedraagt meer dan 85% en de amineopbrengsten zijn hoger dan 90%. Bijproducten zoals nitrilen en amiden worden gerecycled om de opbrengst te verbeteren.
Directe ammonolyse met dehydratatiekatalysatoren wordt uitgevoerd bij 300-500 °C en vergelijkbare drukken. Gebruikte katalysatoren zijn onder andere aluminiumoxide, silica, titaandioxide en aluminiumfosfaat. De opbrengsten bedragen meer dan 80%, met minimale cokesvorming en nitrilvorming, maar de controle over de aminesamenstelling is beperkt.
Isopropylamine wordt voornamelijk gebruikt in de productie van herbiciden, met name 2-chloor-4-ethyl-6-isopropylamino-s-triazine, en in mindere mate in de productie van pesticiden. Di-isopropylamine wordt gebruikt in pesticiden en als corrosieremmer, zoals di-isopropylammoniumnitraat.
2.6. Halogenering van isopropanol
2-Halopropaanderivaten kunnen worden gesynthetiseerd uit isopropylalcohol door reactie met het overeenkomstige zuurhalogenide, wat de meest economische methode is. Fosforhalogeniden en elementaire halogenen kunnen onder geschikte omstandigheden ook reageren om de hydroxylgroep te vervangen en het halogenide te produceren.
Halogenering in waterige oplossing gaat gepaard met oxidatie. Chlorering bij 65 °C produceert chlooracetonderivaten, voornamelijk 1,3-dichlooraceton en 1,1,3-trichlooraceton. Verdere chlorering bij 70-100 °C leidt tot een vrijwel volledige omzetting in producten met een hoger chloorgehalte, waaronder 1,1,1,3,3-pentachlooraceton en hexachlooraceton.
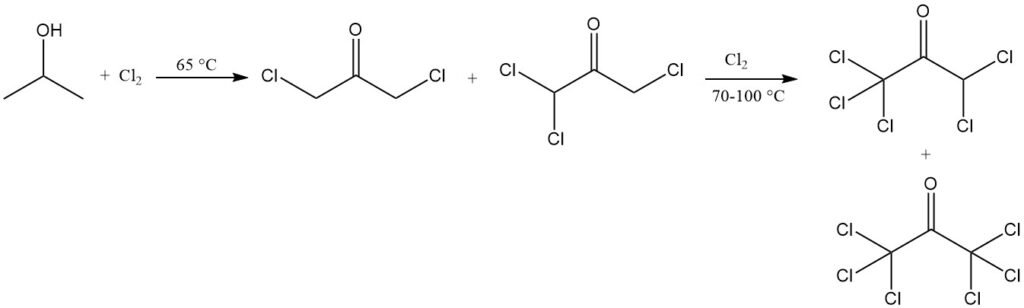
Chlorering van isopropanol onder specifieke omstandigheden kan 1,1,1,3-tetrachlooraceton opleveren, dat kan worden omgezet in 1,1,1-trichloor-2,3-epoxypropaan, een tussenproduct voor landbouw- en farmaceutische chemicaliën, evenals voor moeilijk ontvlambare kunststoffen.
2.7. Diverse reacties van isopropanol
Isopropylalcohol ondergaat acylering met keteen om isopropylacetaat te produceren:
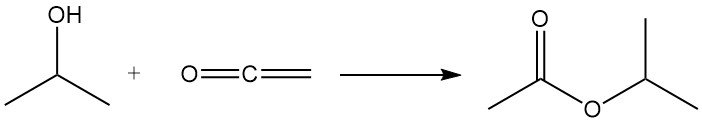
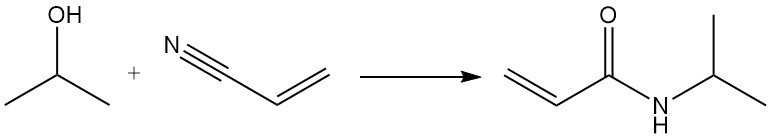
De Ritter-reactie van isopropanol met acrylonitril levert N-isopropylacrylamide op:
Isopropylalcohol kan ook condenseren met aromatische verbindingen zoals tolueen en fenol om geisopropoxyleerde derivaten te vormen die worden gebruikt als tussenproducten bij de synthese van harsen, oppervlakteactieve stoffen en speciale chemicaliën.
3. Industriële productie van isopropanol
Isopropylalcohol wordt industrieel geproduceerd via twee belangrijke processen: indirecte hydratatie en directe hydratatie van propeen. Kleinere volumes worden verkregen door hydrogenering van aceton.
De productie van isopropylalcohol op industriële schaal begon in 1920 in de petrochemische fabriek van Standard Oil (Exxon) in Bayway, New Jersey. In 1921 startte Union Carbide (Carbide and Carbon Chemicals Corporation) de productie in Clendenin, West Virginia. Shell Oil Company startte haar activiteiten in de jaren 30 in Dominguez, Californië. Deze bedrijven bleven de belangrijkste Amerikaanse producenten tot midden jaren 90.
Het indirecte hydratatieproces, ook bekend als het zwavelzuurproces, was historisch gezien de enige commerciële methode tot 1951, toen Imperial Chemical Industries (ICI) het eerste commerciële directe hydratatieproces in gebruik nam.
Beide methoden gebruiken propyleen en water als grondstof. Het indirecte proces is geschikt voor C3-afgasstromen uit raffinaderijen met 40-60 gew.% propyleen, waardoor het geschikt is voor integratie in Amerikaanse raffinaderijen. De directe hydratatieroute werd ontwikkeld om problemen met corrosie, hoog energieverbruik en luchtemissies die gepaard gaan met de indirecte methode te ondervangen; het vereist echter propyleen met een hoge zuiverheidsgraad.
Andere potentiële synthetische methoden zijn onder andere fermentatie van koolhydraten, oxidatie van propaan en hydrolyse van isopropylacetaat. Van deze alternatieve processen is de hydrogenering van het bijproduct aceton uit de fenolproductie het enige commerciële alternatief.
3.1. Productie van isopropanol door indirecte hydratatie van propyleen
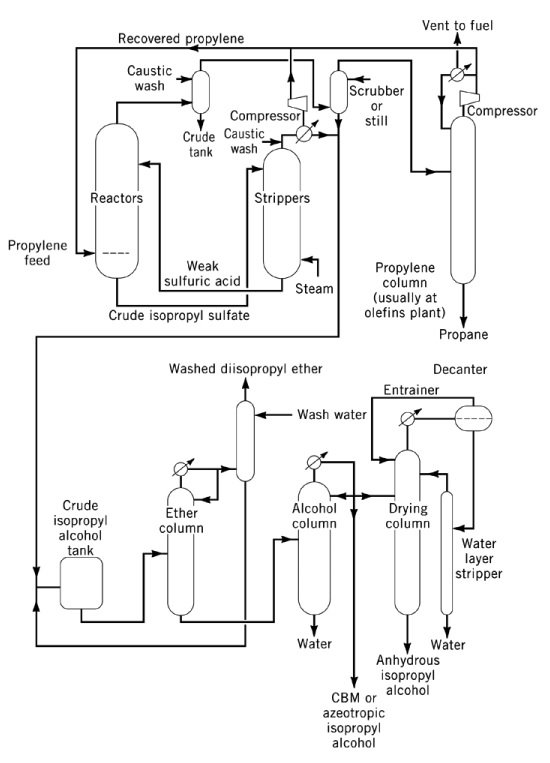
Indirecte hydratatie van propyleen tot isopropylalcohol is een proces in twee stappen waarbij geconcentreerd zwavelzuur als katalysator wordt gebruikt. In de eerste stap vindt verestering plaats om sulfaatesters te vormen, voornamelijk isopropylwaterstofsulfaat, samen met kleinere hoeveelheden di-isopropylsulfaat. In de tweede stap hydrolyse van deze esters levert isopropanol op en regenereert zwavelzuur.
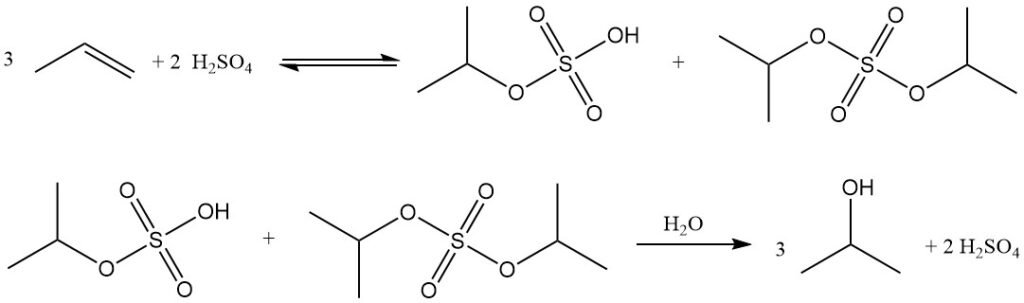
Het belangrijkste bijproduct van dit proces is di-isopropylether (DIPE), gevormd door de reactie van intermediaire sulfaatesters met isopropanol. Andere bijproducten zijn onder andere aceton (afkomstig van thermische ontleding van sulfaatesters), mesityloxide, propyleenoligomeren (dimeren, trimeren) en minder voorkomende alcoholen zoals ethanol, 2-butanol en n-propanol uit verontreinigingen in de voeding.
Zwavelhoudende verbindingen in combinatie met onverzadigde oligomeren kunnen ongewenste geuren veroorzaken, die worden verminderd door geoptimaliseerde reactieomstandigheden en nabehandeling van metalen zoals koper of nikkel.
De reactie wordt uitgevoerd bij 0,7–2,8 MPa en 20–80 °C met zwavelzuurconcentraties boven 60 gew.%. Er zijn twee gangbare bedrijfsmodi:
- Het sterkzuurproces is een tweestapsproces dat >80 gew.% H2SO4 gebruikt bij 1–1,2 MPa en 20–30 °C.
- Het zwakzuurproces is een eenstapsproces dat 60–80 gew.% H2SO4 gebruikt bij circa 2,5 MPa en 60–65 °C.
Beide processen bereiken een selectiviteit van meer dan 98% voor 2-propanol en DIPE.
Het hydrolysaat wordt gestript tot een mengsel van isopropanol, DIPE en water als topproduct, met verdund zwavelzuur als bodemproduct. DIPE wordt over het algemeen teruggevoerd naar de reactor voor hydratatie. Natte isopropanol (87 gew.%, 91 vol.%) wordt verkregen na destillatie, met meer dan 93% omzetting van propyleen. De uiteindelijke dehydratie tot watervrije kwaliteit wordt uitgevoerd door azeotropische destillatie met DIPE of cyclohexaan als entrainers.
Corrosiebeheersing vereist stalen reactoren voor geconcentreerd zuur bij gematigde temperaturen, en roestvrij staal, tantaal of Hastelloy voor verdund zuur bij hogere temperaturen. Isopropylalcohol van hoge zuiverheid of essencekwaliteit wordt geproduceerd door nabehandeling over actieve kool, moleculaire zeven of metaalhoudende vaste bedden, gevolgd door de uiteindelijke destillatie in non-ferro apparatuur.
Indirecte hydratatie blijft de belangrijkste commerciële route in de Verenigde Staten en wordt ook toegepast door verschillende Europese en Japanse producenten.
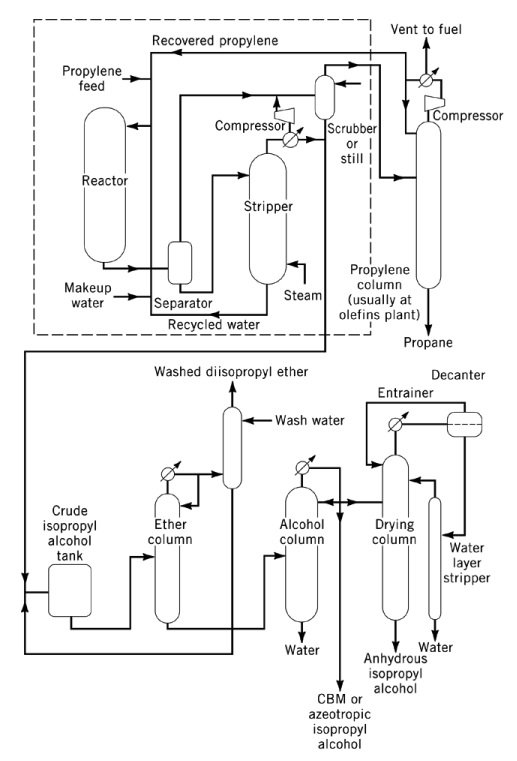
3.2. Productie van isopropanol door directe hydratatie van propyleen
De directe hydratatie van propyleen tot 2-propanol is een zuurgekatalyseerde, exotherme reactie met een reactiewarmte van -50 kJ/mol. Thermodynamisch gezien bevorderen hoge drukken en lage temperaturen de vorming van isopropylalcohol, hoewel de meeste katalysatoren matige tot hoge temperaturen vereisen om commerciële opbrengsten te behalen.
Commerciële directe hydratatieprocessen worden ingedeeld in drie hoofdtypen: dampfasehydratatie, gemengde damp-vloeistoffasehydratatie en vloeistoffasehydratatie.
In dampfaseprocessen, zoals de Veba-Chemie- en ICI-processen, worden propyleen en waterdamp over een zure katalysator met een vast bed geleid. Het Veba-Chemie-proces gebruikt fosforzuur op silica bij 240–260 °C en 2,5–6,6 MPa om een selectiviteit van 96% te bereiken met een conversie van 5–6% per passage.
Het ICI-proces maakt gebruik van een wolfraamoxide-zinkoxidekatalysator op silica bij 230-290 °C en 20,3-25,3 MPa. In beide gevallen vereisen de hoge temperatuur en lage drukgrensconversie daarom uitgebreide recycling van propyleen. De zuiverheidseisen voor de grondstof liggen doorgaans rond de 99 gew.%.
De gemengde damp-vloeistoffasehydratatie, ontwikkeld door Deutsche Texaco AG, wordt uitgevoerd in een trickle-bedreactor met een sulfonzuurkationenwisselaarhars als katalysator. De reactie werkt bij 130-160 °C en 8-10 MPa met een molaire verhouding propyleen/water van 1:12-15.
Dit proces bereikt een conversie van meer dan 75% per doorgang en een selectiviteit van 93% wanneer de zuiverheid van de grondstof ten minste 92 gew.% bedraagt. Bijproducten die tijdens de reactie worden gevormd, omvatten ongeveer 5% di-isopropylether (DIPE) en kleine hoeveelheden hogere oligomere alcoholen. De levensduur van de katalysator bedraagt bij normaal gebruik meer dan acht maanden.
Vloeistoffasehydratatie, zoals ontwikkeld door Tokuyama Soda, maakt gebruik van een zwak zure waterige silicowolframaatkatalysator bij 270 °C en 20,3 MPa. Het proces levert een conversie van 60-70% per doorgang op met een selectiviteit van 98-99 mol%.
De katalysator wordt gerecycled met minimaal verlies en het proces vertoont lage corrosie en verwaarloosbare emissies. De zuiverheid van de grondstof is 95 gew.% of hoger. Het ruwe isopropanolproduct, verkregen door azeotropische destillatie, bevat 88 gew.% isopropanol en wordt vervolgens gezuiverd tot een zuiverheid van meer dan 99,99%.
Katalysatoren die bij directe hydratatie worden gebruikt, zijn sterke zuren die propyleen kunnen protoneren om een secundair carbokation te vormen. Voorbeelden hiervan zijn fosforzuur op drager, wolfraamoxide, molybdofosforzuur, titaanoxide, zinkoxide, zirkoonoxide, silicowolframaten, molybdeenoxalaat en diverse zeolieten.
Sterk zure ionenwisselaarharsen hebben de voorkeur voor gebruik bij gematigde temperaturen. Bepaalde polyzuuranionen, zoals fosfomolybdaat en fosfowolframaat, blijken de hydratatiesnelheid te verhogen in vergelijking met sulfaat of fosfaat, mogelijk vanwege specifieke ionenassociatie-effecten met het carbokation.
Het reactiemechanisme omvat protonering van propyleen om een secundair carboniumion te genereren, gevolgd door nucleofiele aanval door water om geprotoneerde isopropylalcohol te produceren, die vervolgens deprotoneert tot de neutrale alcohol. De reactiesnelheid is evenredig met de hydroniumionconcentratie en onafhankelijk van het tegenanion, hoewel polyzuuranionen de snelheid kunnen versnellen.
Vanuit thermodynamisch perspectief wordt de evenwichtsconstante in de dampfase gegeven door log K = 2624/T – 7,584, en in de vloeistoffase is de standaard vrije energie ΔF° = 23,25T – 9352 (waarbij T in K is).
Lage temperaturen verminderen de vorming van DIPE, maar de katalysatoractiviteit stelt een praktische ondergrens. Hoge drukken verhogen de alcoholconcentratie en verminderen de noodzaak voor uitgebreide propyleenrecycling.
3.3. Productie van isopropanol door hydrogenering van aceton
Hydrogenering van aceton wordt toegepast in de Verenigde Staten, Rusland, Azië en Zuid-Amerika. Het proces kan worden uitgevoerd in de vloeibare fase met een vastbed Raney-nikkelkatalysator en bereikt een selectiviteit van 99,9% en een omzetting van 99,9% van aceton.
Als alternatief geeft hydrogenering met een koperoxide-chroomoxidekatalysator bij 120 °C en 196 kPa een lagere selectiviteit van ongeveer 98% en een omzetting van ongeveer 94%. Aceton met een hoge zuiverheidsgraad is niet nodig voor dit proces, waardoor het bijzonder voordelig is in installaties waar overtollig aceton als bijproduct wordt gegenereerd, zoals in het cumeen-fenolproces.
4. Toepassingen van isopropanol
Isopropylalcohol (isopropanol) wordt voornamelijk gebruikt als industrieel oplosmiddel, chemisch tussenproduct en antisepticum.
4.1. Toepassingen van isopropanol in de chemische industrie
Belangrijke chemische derivaten van isopropanol zijn onder andere methylisobutylketon (MIBK), methylisobutylcarbinol (MIBC), diisobutylketon (DIBK) en isopropylacetaat. 2-propanol is ook een grondstof voor de productie van isopropylamines, die worden gebruikt bij de productie van herbiciden en pesticiden. Een deel van de diisopropylamine wordt gebruikt bij de synthese van diisopropylammoniumnitraat, een corrosieremmer.
Het gebruik van isopropylalcohol voor de productie van aceton is aanzienlijk afgenomen door de toenemende populariteit van het cumeenoxidatieproces.
4.2. Toepassingen van isopropanol als oplosmiddel
Als oplosmiddel heeft isopropylalcohol evenwichtige alcohol-, water- en koolwaterstofachtige eigenschappen, waardoor het effectief is voor het oplossen van oliën, gomsoorten, wassen, harsen en alkaloïden. Het wordt gebruikt bij de samenstelling van cement, primers, lakken, verven, drukinkten, coatings en extractieprocessen.
In cosmetica en persoonlijke verzorgingsproducten wordt het gebruikt als oplosmiddel voor lotions, parfums, shampoos, huidreinigers, nagellakken, make-upremovers, deodorants en lichaamsoliën, met toegevoegde parfums om de geur te maskeren.
Aerosolformuleringen met isopropylalcohol zijn onder andere haarsprays, schoonmaakproducten, insecticiden, dooimiddelen voor auto’s, luchtverfrissers, desinfectiemiddelen en diverse huishoudelijke en industriële sprays.
4.3. Medisch gebruik van isopropanol
In de farmaceutische sector wordt isopropylalcohol gebruikt als oplosmiddel voor verwerking en als actief antisepticum en desinfectiemiddel in woningen, ziekenhuizen en industriële omgevingen. Het is effectiever dan ethanol voor microbiële bestrijding en wordt veel gebruikt in 70% waterige oplossingen als ontsmettingsalcohol.
Het is ook aanwezig in medicinale linimenten, tincturen, hoofdhuidtonics, chirurgische hechtingsbaden en verbandoplossingen, evenals in formuleringen zoals jodiumtinctuur en groene zeep.
4.4. Overige toepassingen
Hoogzuivere isopropylalcohol (99,99%) wordt in de elektronica-industrie gebruikt voor het reinigen van grootschalige integratie (LSI)-apparaten en siliciumwafers. Andere toepassingen zijn onder andere het gebruik als octaanverbeteraar, anti-ijsvormingsadditief voor carburateurs en als cosolvent met methanol in benzinemengsels.
In extractieprocessen worden waterige oplossingen van isopropylalcohol toegepast voor vloeistof-vloeistofextractie van vetzuren uit plantaardige oliën bij lage temperaturen.
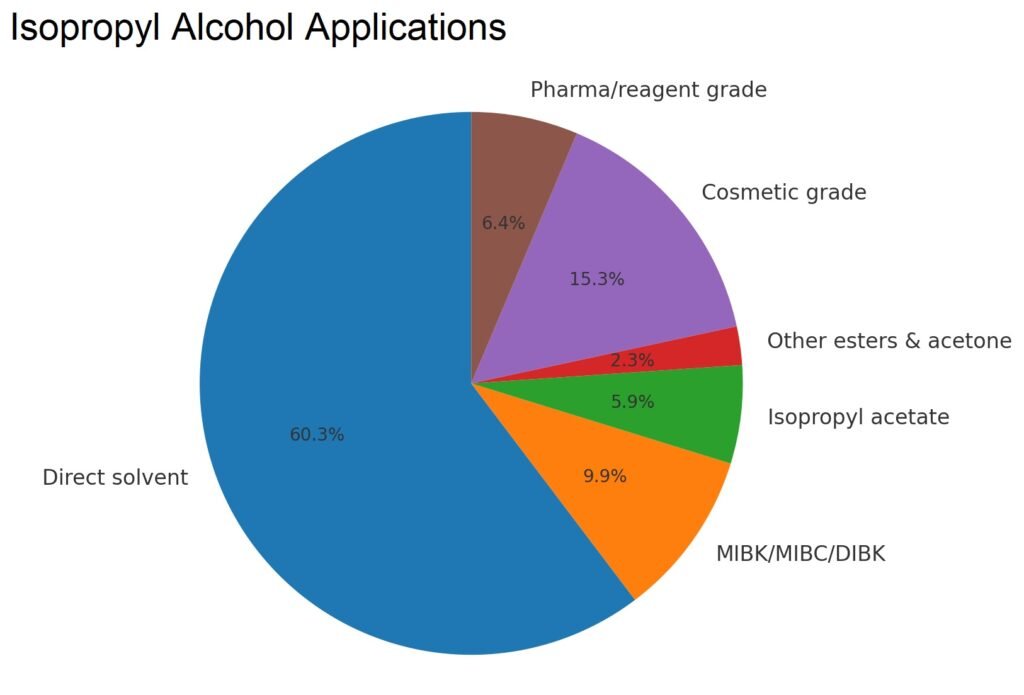
De Amerikaanse consumptiegegevens in tabel 3 tonen de primaire toepassingen van isopropanol in oplosmiddelen, coatings, chemische derivaten, cosmetica, farmaceutische producten en specialistische toepassingen, met trends die wijzen op een daling van de productie van aceton en isopropylamine, maar een stabiel gebruik in cosmetica, farmaceutische producten en hoogwaardige oplosmiddelen.
| Jaar | |||
|---|---|---|---|
| 2002 | 2008 | 2014 | |
| Direct oplosmiddel | 243 | 269 | 237 |
| Chemische derivaten | |||
| MIBK/MIBC/DIBK | 71 | 45 | 39 |
| Isopropylaminen | 85 | 50 | – |
| Isopropylacetaat | 24 | 17 | 23 |
| Andere esters en aceton | 17 | 17 | 9 |
| Cosmetische kwaliteit | 52 | 56 | 60 |
| Farmaceutische (USP-kwaliteit)/reagenskwaliteit | 21 | 25 | 25 |
| Totaal | 513 | 479 | 393 |
5. Toxicologie van isopropanol
Isopropylalcohol is wijdverspreid aanwezig in huishoudelijke en industriële producten, waaronder ontsmettingsalcohol, desinfectiemiddelen, reinigingsmiddelen, cosmetica, farmaceutische producten en oplosmiddelen. De toxiciteit is hoger dan die van ethanol, ongeveer twee keer zo hoog, maar lager dan die van methanol. De primaire blootstellingsroute is inname, met minder frequente gevallen door inademing of blootstelling via de huid.
Isopropylalcohol wordt na inname snel opgenomen, met piekplasmaconcentraties die binnen 30 minuten worden bereikt. Het is wijd verspreid in het lichaamswater, met een distributievolume van 0,45-0,55 l/kg.
De stofwisseling vindt voornamelijk plaats in de lever door alcoholdehydrogenase tot aceton, acetol, methylglyoxal, propyleenglycol, acetaat en formiaat, gevolgd door omzetting in glucose en andere metabolische producten.
Aceton is de belangrijkste metaboliet en verschijnt binnen 15 minuten na inname in de adem. De eliminatie vindt voornamelijk plaats via de nieren, waarbij 20% onveranderd wordt uitgescheiden en de rest als aceton en zijn metabolieten. De eliminatiehalfwaardetijd van isopropylalcohol is 2,5-8 uur, terwijl de eliminatie van aceton langzamer is, met een halfwaardetijd van 7,7-27 uur.
Het toxiciteitsmechanisme is voornamelijk hersenstamdepressie, veroorzaakt door zowel isopropylalcohol als, in mindere mate, aceton. De klinische kenmerken variëren van lichte intoxicatie tot ernstige depressie van het centrale zenuwstelsel (CZS) en ademhalingsdepressie, circulatoire collaps, shock en coma. Vroege symptomen zijn onder meer ataxie, braken, buikpijn en hematemese, die in ernstige gevallen overgaan in hypotensie, hypothermie en verlies van reflexen.
In tegenstelling tot methanol en ethyleenglycol veroorzaken isopropylalcohol en aceton geen metabole acidose met een hoge anion gap, maar produceren ze ketonemie, ketonurie en een verhoogde osmolaire gap. Een fruitige geur in de adem is kenmerkend.
De toxische dosis van 70% isopropylalcohol is ongeveer 1 ml/kg en inname van 100-250 ml kan fataal zijn. De dood is het gevolg van verlamming van het centrale zenuwstelsel. Inademing van hoge dampconcentraties kan verdovende effecten en lichte irritatie van de ogen, neus en keel veroorzaken.
De grenswaarden voor beroepsmatige blootstelling zijn door OSHA en ACGIH vastgesteld op 400 ppm (8-uurs TWA) en 500 ppm (STEL). De geurdrempel varieert van 3 tot 200 ppm. Industrieel gebruik vormt onder normale omstandigheden geen significant gezondheidsrisico.
Dierstudies, waaronder subchronische inhalatie, neurotoxiciteit, ontwikkelings-, reproductie- en oncogeniciteitstests, hebben geen nadelige effecten aangetoond.
De diagnose van isopropanolvergiftiging is gebaseerd op de blootstellingsgeschiedenis, klinische bevindingen en laboratoriumresultaten die een osmolaire gap met ketose aantonen bij afwezigheid van metabole acidose. Meting van de serumisopropylalcoholconcentratie kan de blootstelling bevestigen, maar is niet altijd beschikbaar.
De behandeling van isopropanolvergiftiging is primair gericht op het ondersteunen van het behoud van vitale functies, waaronder bescherming van de luchtwegen, cardiovasculaire stabilisatie (om mogelijke hypotensie te behandelen) en het bewaken van de zuur-base- en elektrolytenbalans van de patiënt. Actieve kool is niet effectief bij dit type vergiftiging en wordt daarom niet aanbevolen.
Hemodialyse bevordert de eliminatie van zowel isopropylalcohol als aceton, maar wordt over het algemeen alleen toegepast bij ernstige, levensbedreigende gevallen met ernstige hypotensie, coma of zeer hoge serumconcentraties. De meeste patiënten herstellen volledig met snelle ondersteunende zorg.
Referenties
- Klabunde, J., Bischoff, C. and Papa, A.J. (2025). Propanols. In Ullmann’s Encyclopedia of Industrial Chemistry. https://doi.org/10.1002/14356007.a22_173.pub3
- Logsdon, J.E. and Loke, R.A. (2000). Isopropyl Alcohol. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0919151612150719.a01
- Jolliff, H.A. (2017). Isopropyl Alcohol. In: Brent, J., et al. Critical Care Toxicology. Springer, Cham. https://doi.org/10.1007/978-3-319-17900-1_53
- Co, I. N.; Gunnerson, K. J. Chapter 71 – Iatrogenic and Poison-Derived Acid Base Disorders. In Critical Care Nephrology, 3rd ed.; Ronco, C., Bellomo, R., Kellum, J. A., Ricci, Z., Eds.; Elsevier, 2019; pp 417-423.e2. DOI: 10.1016/B978-0-323-44942-7.00071-6
- Gwaltney-Brant, S. M. Chapter 24 – Miscellaneous Indoor Toxicants. In Small Animal Toxicology, 3rd ed.; Peterson, M. E., Talcott, P. A., Eds.; W.B. Saunders, 2013; pp 291-308. DOI: 10.1016/B978-1-4557-0717-1.00024-7
- Slaughter, R. J., Mason, R. W., Beasley, D. M. G., Vale, J. A., & Schep, L. J. (2014). Isopropanol poisoning. Clinical Toxicology, 52(5), 470–478. https://doi.org/10.3109/15563650.2014.914527
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Chemical Agents and Related Occupations. Lyon (FR): International Agency for Research on Cancer; 2012. (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 100F.) ISOPROPYL ALCOHOL MANUFACTURE BY THE STRONG-ACID PROCESS. Available from: https://www.ncbi.nlm.nih.gov/books/NBK304434/
- Carls, R.-R.; Osterburg, G.; Prezelj, M.; Webers, W. “Process for the production of isopropyl alcohol.” U.S. Patent 4,760,203, 1988. Available from: https://patents.google.com/patent/US4760203A/en
- Hirata, S.; Ogawa, S. “Process for producing isopropyl alcohol.” U.S. Patent 5,763,693, 1998. Available from: https://patents.google.com/patent/US5763693A/en
- Gershbein, L. L.; Pines, H.; Ipatieff, V. N. “Reactions of Isopropyl Alcohol in the Presence of Catalysts Containing Magnesium Oxide.” J. Am. Chem. Soc., 1947, 69 (11), 2888–2893. DOI: 10.1021/ja01203a074