Isopropanolo: proprietà, reazioni chimiche, produzione industriale, applicazioni e tossicologia
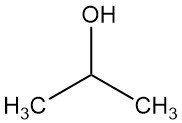
Cos’è l’isopropanolo?
L’alcol isopropilico, noto anche come isopropanolo o 2-propanolo, è l’alcol secondario più semplice con formula chimica C3H7OH. È un liquido incolore, volatile e infiammabile, dal sapore leggermente amaro e un odore tenue simile a una miscela di etanolo e acetone.
L’isopropanolo si trova in natura negli oli di fusel grezzi e come prodotti di fermentazione e decomposizione di vari vegetali. È considerato il primo alcol di origine petrolchimica e, tra gli alcoli inferiori (C1–C5), si colloca al terzo posto nella produzione mondiale dopo metanolo ed etanolo.
Sommario
1. Proprietà fisiche dell’isopropanolo
L’alcol isopropilico (isopropanolo) è un alcol secondario completamente miscibile con acqua e facilmente solubile in un’ampia gamma di solventi organici comuni, inclusi eteri, esteri, chetoni, acidi e altri alcoli.
La solubilità dell’isopropanolo in acqua diminuisce in presenza di sali disciolti e l’aggiunta di sali come il cloruro di sodio o il solfato di sodio induce la separazione di fase, producendo uno strato organico immiscibile. Questa proprietà viene sfruttata nell’estrazione di composti polari da soluzioni acquose.
Le proprietà fisiche dell’alcol isopropilico sono influenzate dal suo gruppo ossidrilico polare (–OH) e dalla sua struttura alcolica secondaria. Ha punti di ebollizione e di infiammabilità inferiori a quelli dell’n-propanolo, mentre la sua tensione di vapore e il suo punto di congelamento sono più elevati.
La Tabella 1 riporta le proprietà fisiche dell’isopropanolo anidro e della sua miscela azeotropica al 91% in volume con acqua.
| Proprietà | Anidro | 91% in volume |
|---|---|---|
| Peso molecolare | 60,10 | |
| Punto di ebollizione, a 101,3 kPa, °C | 82,3 | 80,4 |
| Punto di congelamento, °C | −88,5 | −50,0 |
| Peso specifico, 20/20 | 0,7864 | 0,8183 |
| densità, a 20 °C, g/cm3 | 0,7854 | 0,8173 |
| tensione superficiale, a 20 °C, mN/m(= din/cm) | 21,32 | 21,40 |
| calore specifico, liquido a 20 °C, J/(kg·K) | 2510,4 | |
| indice di rifrazione | 1,3772 | 1,3769 |
| calore di combustione, a 25 °C, kJ/mol | 2005,8 | |
| calore latente di vaporizzazione, a 101,3 kPa, kJ/mol | 39,8 | |
| pressione di vapore, a 20 °C, kPa | 4,4 | 4,5 |
| temperatura critica, °C | 235,2 | |
| Pressione critica, a 20 °C, kPa | 4764 | |
| Viscosità, mPa·s(= cP) a 0 °C | 4,6 | |
| Viscosità, mPa·s(= cP) a 20 °C | 2,4 | 2,1 |
| Viscosità, mPa·s(= cP) a 40 °C | 1,4 | |
| limite di infiammabilità in aria, vol % | inferiore: 2,5 superiore: 12 |
|
| punto di infiammabilità, °C (vaso aperto) | 17,2 | 21,7 |
| punto di infiammabilità, °C (vaso chiuso) | 11,7 | 18,3 |
| temperatura di autoaccensione, °C | 399 |
Negli Stati Uniti, l’isopropanolo commerciale è prevalentemente costituito da alcol isopropilico anidro e da un azeotropo acquoso al 91% in volume, noto come miscela a ebollizione costante. Le formulazioni a base di alcol denaturato contengono in genere il 70% o più di alcol isopropilico in acqua.
L’isopropanolo forma anche azeotropi con vari composti, tra cui idrocarburi, esteri, idrocarburi alogenati, ammine, chetoni e idrocarburi aromatici. Non forma azeotropi binari con acetone, etanolo, etilbenzene, esilammina o metilisobutilchetone, ma può formare sistemi azeotropici ternari con alcuni di questi composti.
Esempi di alcuni azeotropi binari dell’alcol isopropilico sono riportati nella Tabella 2.
| Componente | Punto di ebollizione, °C | Punto di ebollizione dell'azeotropo, °C | Composizione dell'alcol isopropilico, % in peso |
|---|---|---|---|
| acqua | 100 | 80,3 | 87,4 |
| toluene | 110,6 | 80,6 | 69 |
| propionato di metile | 79,6 | 77 | 28 |
| metil etil chetone | 79,6 | 77,9 | 32 |
| acetato di etile | 77,05 | 75,9 | 25 |
| 2-clorobutano | 68,25 | 64 | 18 |
| esano | 68,9 | 62,7 | 23 |
| cicloesano | 80,8 | 68,6 | 33 |
| butilammina | 77,8 | 84,7 | 60 |
| etere diisopropilico | 69 | 66,2 | 16,3 |
2. Reazioni chimiche dell’isopropanolo
Le proprietà chimiche dell’isopropanolo sono determinate dalla presenza di un gruppo ossidrilico secondario. La sua reattività è caratteristica degli alcoli secondari ed è generalmente maggiore a livello del gruppo ossidrilico rispetto agli alcoli primari come l’alcol n-propilico o l’alcol etilico. La maggior parte delle reazioni comporta la scissione del legame C–OH o O–H.
L’alcol isopropilico subisce un’ampia gamma di trasformazioni, tra cui deidrogenazione, ossidazione, esterificazione, eterificazione, amminazione e alogenazione. Esempi di importanza industriale includono la preparazione di isopropossido di alluminio e alogenuri di isopropile.
L’isopropossido di alluminio viene prodotto in resa quantitativa mediante riflusso di alcol isopropilico con alluminio metallico in presenza di quantità catalitiche di cloruro mercurico:
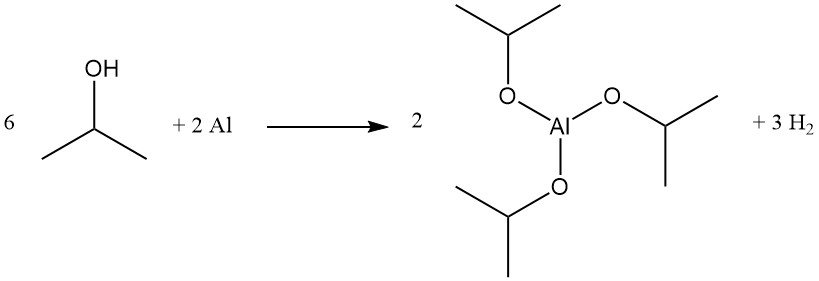
Questo composto è un efficace agente riducente Meerwein-Ponndorf-Verley per alcune reazioni di scambio di esteri e di riduzione di carbonili ed è utilizzato come precursore del glicinato di alluminio, un agente tampone.
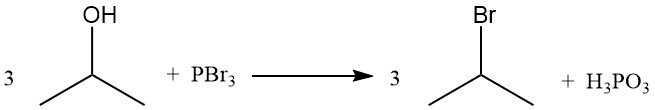
Gli alogenuri isopropilici, come il bromuro di isopropile, si ottengono per spostamento del gruppo ossidrilico mediante reazione con alogenuri di idrogeno. Il riflusso di alcol isopropilico con acido bromidrico produce bromuro di isopropile e acqua:
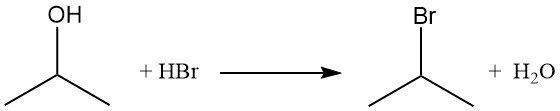
L’ordine di reattività con gli alogenuri di idrogeno è HI > HBr > HCl. La reazione con acido cloridrico per formare cloruro di isopropile è catalizzata dalla presenza di cloruro di zinco.
L’alcol isopropilico può essere deprotonato per produrre sali di isopropossido, ampiamente utilizzati come basi forti non nucleofile nella sintesi organica.
Nelle reazioni di idrogenazione catalitica per trasferimento, viene utilizzato come riducente terminale per la riduzione di aldeidi, chetoni e altri gruppi funzionali. Durante queste reazioni, il 2-propanolo viene ossidato ad acetone.
Questo processo è reversibile e un contatto prolungato tra il prodotto e il catalizzatore può ridurre l’enantiopurezza nelle riduzioni asimmetriche. L’equilibrio può essere spostato verso la formazione del prodotto utilizzando un eccesso di isopropanolo, rimuovendo l’acetone tramite distillazione o separando il prodotto ridotto dal mezzo di reazione.
2.1. Deidrogenazione dell’isopropanolo
La deidrogenazione dell’alcol isopropilico è un’importante reazione industriale per la produzione di acetone. Prima della coproduzione su larga scala di acetone nei processi di produzione di fenoli, era il principale metodo commerciale per la sintesi dell’acetone.
Il processo è endotermico, con un fabbisogno termico di 66,5 kJ/mol a 327 °C. Viene condotto in fase vapore a temperature di 300-500 °C e pressioni moderate intorno ai 207 kPa, per ottenere una selettività all’acetone di circa il 90% e una conversione del 2-propanolo del 98%.
I catalizzatori comunemente utilizzati includono rame, cromo, zinco e nichel, applicati singolarmente, come ossidi o in forme miste supportate su materiali inerti. Una reazione rappresentativa è:

La selettività verso l’acetone è elevata, ma si formano piccole quantità di sottoprodotti attraverso processi di disidratazione, condensazione o ossidazione. Questi includono propilene, etere diisopropilico, ossido di mesitile, acetaldeide e propionaldeide.
La reazione può avvenire anche in fase liquida.
La deidrogenazione dell’alcol isopropilico può anche essere eseguita per via ossidativa utilizzando catalizzatori all’argento o al rame a temperature di 400-600 °C. Processi brevettati descrivono la deidrogenazione ossidativa in fase vapore per la produzione di chetoni misti, tra cui acetone, metilisobutilchetone e chetoni superiori.
In un esempio, la deidrogenazione in fase vapore di una miscela azeotropica di 2-propanolo e acqua su un catalizzatore a base di rame a 220 °C produce una miscela contenente acetone (52,4%), 2-propanolo non reagito (11,4%), metilisobutilchetone (21,6%), diisobutilchetone (6,5%) e 4-metil-2-pentanolo (2,2%).
2.2. Ossidazione dell’isopropanolo
L’alcol isopropilico subisce un’ossidazione catalitica con aria o ossigeno a 400-600 °C per produrre acetone e acqua:
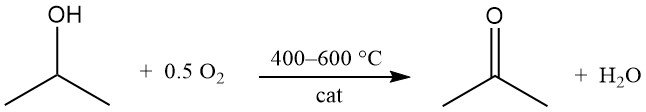
I catalizzatori sono simili a quelli utilizzati nei processi di deidrogenazione. A differenza della deidrogenazione, la reazione di ossidazione è altamente esotermica e rilascia 180 kJ/mol a 295 °C. Un attento controllo delle condizioni di processo è necessario per limitare la formazione di sottoprodotti, in particolare dai processi di disidratazione.
L’ossidazione e la deidrogenazione possono essere eseguite simultaneamente con catalizzatori e condizioni operative adeguati, sebbene l’uso industriale dell’ossidazione per la produzione di acetone sia limitato rispetto alla deidrogenazione.
L’ossidazione parziale dell’alcol isopropilico può essere eseguita in fase liquida senza catalizzatore per produrre perossido di idrogeno e acetone:
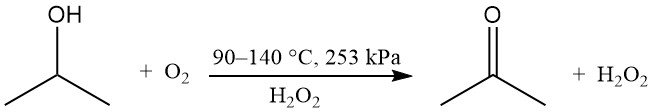
L’ossigeno o l’aria vengono utilizzati con un iniziatore perossidico, come il perossido di idrogeno. La velocità di reazione è influenzata dalla concentrazione dell’acido acetico come sottoprodotto. Il rapporto in peso teorico tra acetone e perossido di idrogeno è 1,7. Questo metodo viene utilizzato quando il perossido di idrogeno è il prodotto desiderato, mentre l’acetone e l’isopropanolo non reagito vengono riciclati.
Nel processo Shell, il perossido di idrogeno prodotto in questo modo viene utilizzato per ossidare l’alcol allilico ad acroleina, mentre nel processo Burmah Oil viene convertito in acido peracetico.
Il 2-propanolo reagisce anche con aldeidi o chetoni α,β-insaturi su catalizzatori a base di ossidi metallici a temperature elevate. In un processo Shell per la produzione di alcol allilico, una miscela in fase vapore di isopropanolo e acroleina viene fatta passare su ossido di magnesio e ossido di zinco non calcinati a 400 °C per produrre circa il 77% di alcol allilico a base di acroleina.
2.3. Esterificazione dell’isopropanolo
L’isopropanolo subisce esterificazione con acidi carbossilici in presenza di catalizzatori acidi come l’acido p-toluensolfonico. La reazione viene tipicamente eseguita a 100-160 °C e a pressione atmosferica, utilizzando un eccesso di alcol per portare l’equilibrio verso la formazione di esteri.
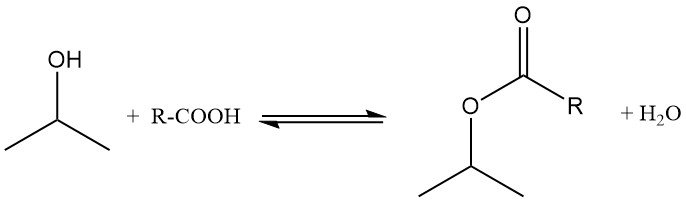
L’acqua formatasi durante la reazione viene rimossa come azeotropo per modificare l’equilibrio. L’isopropanolo in eccesso viene distillato e riciclato, e le rese di esteri si avvicinano a livelli quantitativi. Ad esempio, l’acetato di isopropile viene preparato da isopropanolo e acido acetico in presenza di acido solforico, utilizzando il toluene come agente azeotropico.
Sono stati condotti studi cinetici sull’esterificazione dell’isopropanolo con vari acidi organici utilizzando resine a scambio cationico solfonate. La reazione con l’acido miristico produce isopropil miristato, un emolliente e lubrificante utilizzato in cosmetici e prodotti farmaceutici topici. Una forma gelatinosa di questo estere è commercializzata come Estergel.
L’alcol isopropilico reagisce con il disolfuro di carbonio per produrre esteri xantati. L’isopropil xantato di sodio viene utilizzato nei processi di flottazione minerale e come erbicida nella coltivazione di fagioli e piselli.
La reazione del 2-propanolo con alogenuri di fosforo forma esteri di fosfito. Il triisopropilfosfito si ottiene da tricloruro di fosforo e isopropanolo a basse temperature in presenza di uno scavenger di acidi come la piridina:
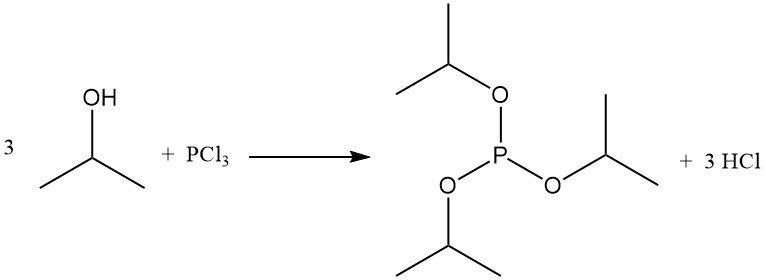
Il tetracloruro di titanio reagisce con l’isopropanolo per produrre tetra(isopropil)titanato, un catalizzatore di polimerizzazione commerciale.
Il nitrato di isopropile viene preparato mediante la reazione dell’isopropanolo con l’acido nitrico, alimentando separatamente i reagenti in un alambicco e rimuovendo continuamente il prodotto per distillazione.
Il nitrato di isopropile viene utilizzato come combustibile per l’avviamento dei motori e in formulazioni esplosive. L’estere nitritico, il nitrito di isopropile, si forma a temperatura ambiente da isopropanolo e cloruro di nitrosile o acido nitroso e funge da propellente per motori a reazione.
2.4. Eterificazione dell’isopropanolo
L’alcol isopropilico può essere disidratato in fase liquida su catalizzatori fortemente acidi, come l’acido solforico, o in fase vapore su allumina acida per produrre etere diisopropilico (DIPE) o propilene.
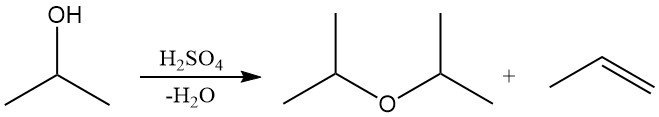
La selettività verso DIPE o propilene dipende dalla scelta del catalizzatore e dalle condizioni di reazione. Industrialmente, il DIPE si ottiene principalmente come sottoprodotto durante la produzione di alcol isopropilico. Il DIPE in eccesso viene spesso riciclato su catalizzatori acidi per rigenerare l’isopropanolo tramite idratazione. Il DIPE viene utilizzato in quantità limitate come solvente e nei processi di estrazione industriale.
Il Clean Air Act statunitense del 1990, che ha imposto l’uso di ossigenati nella benzina, ha creato una potenziale domanda di DIPE come ossigenato per carburante. Il DIPE può essere sintetizzato facendo reagire l’alcol isopropilico con il propilene su catalizzatori acidi a scambio ionico a basse temperature.
I glicoleteri possono anche essere preparati dall’alcol isopropilico mediante reazione con ossidi di olefine come l’ossido di etilene o l’ossido di propilene. Ad esempio, la reazione con ossido di etilene produce 2-isopropossietanolo (commercialmente noto come isopropil Cellosolve), tipicamente catalizzato da idrossidi alcalini.
L’alcossilazione secondaria del prodotto iniziale con ulteriore ossido di olefina forma derivati alcossilati superiori (oligomeri). Questa reazione competitiva è particolarmente significativa quando si utilizza ossido di etilene, poiché il gruppo idrossilico primario terminale prodotto è più reattivo.
I glicoleteri derivati dall’alcol isopropilico sono utilizzati come solventi in lacche, smalti e rivestimenti a base acquosa per migliorarne la lucentezza, la distensione e le proprietà del film.
2.5. Amminazione dell’isopropanolo
L’alcol isopropilico viene amminato per ammonolisi con catalizzatori di disidratazione o per ammonolisi riduttiva utilizzando catalizzatori di idrogenazione. Entrambi i metodi producono isopropilammina e diisopropilammina. La triisopropilammina si forma solo in quantità trascurabili.
Il rapporto tra mono- e diisopropilammina dipende dal rapporto molare tra alcol isopropilico e ammoniaca, che in genere varia da 2:1 a 5:1.
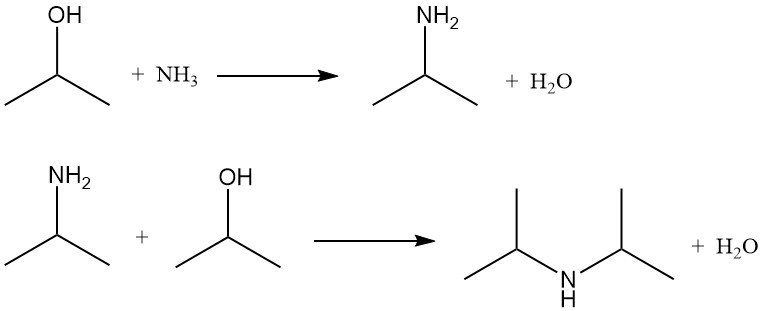
Nell’ammonolisi riduttiva, l’idrogeno è presente per prolungare la durata del catalizzatore prevenendo la formazione di coking e catrame, ma non viene consumato in modo significativo. La reazione viene normalmente condotta a 150-250 °C e 790-2860 kPa in un reattore a letto fisso utilizzando catalizzatori costituiti da rame, cromo o nichel supportati su allumina.
La conversione dell’alcol isopropilico supera l’85% e le rese in ammina sono superiori al 90%. Sottoprodotti come nitrili e ammidi vengono riciclati per migliorare la resa.
L’ammonolisi diretta con catalizzatori di disidratazione viene condotta a 300-500 °C e pressioni simili. I catalizzatori utilizzati includono allumina, silice, biossido di titanio e fosfato di alluminio. Le rese superano l’80%, con formazione minima di coking e nitrili, ma il controllo sulla composizione amminica è limitato.
L’isopropilammina è utilizzata principalmente nella produzione di erbicidi, in particolare per la 2-cloro-4-etil-6-isopropilammino-s-triazina, e in misura minore nella produzione di pesticidi. La diisopropilammina è utilizzata nei pesticidi e come inibitore di corrosione, come il nitrato di diisopropilammonio.
2.6. Alogenazione dell’isopropanolo
I derivati del 2-alopropano possono essere sintetizzati dall’alcol isopropilico mediante reazione con il corrispondente alogenuro acido, che è il metodo più economico. Anche gli alogenuri di fosforo e gli alogeni elementari possono reagire, in condizioni adeguate, per sostituire il gruppo ossidrilico e produrre l’alogenuro.
L’alogenazione in soluzione acquosa è accompagnata da ossidazione. La clorazione a 65 °C produce derivati del cloroacetone, principalmente 1,3-dicloroacetone e 1,1,3-tricloroacetone. Un’ulteriore clorazione a 70-100 °C porta alla conversione quasi completa in prodotti a più alto contenuto di cloro, tra cui 1,1,1,3,3-pentacloroacetone ed esacloroacetone.
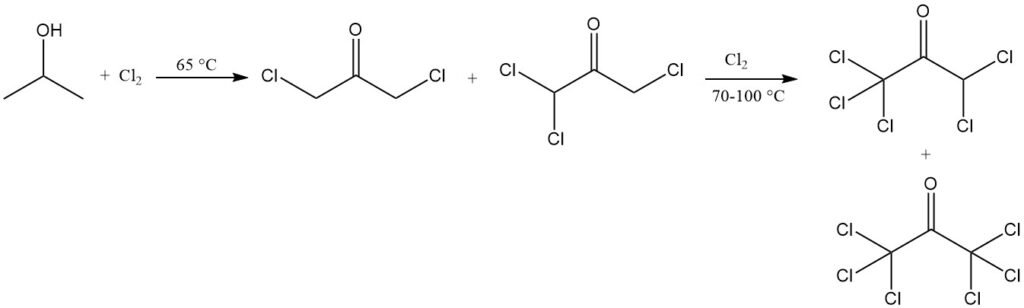
La clorazione dell’isopropanolo in condizioni specifiche può produrre 1,1,1,3-tetracloroacetone, che può essere convertito in 1,1,1-tricloro-2,3-epossipropano, un intermedio per prodotti chimici agricoli e farmaceutici, nonché per materie plastiche a bassa infiammabilità.
2.7. Reazioni varie dell’isopropanolo
L’alcol isopropilico subisce acilazione con chetene per produrre acetato di isopropile:
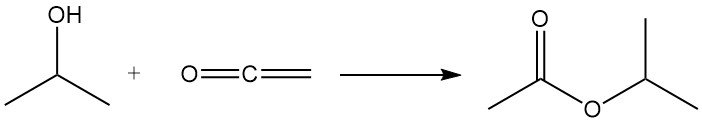
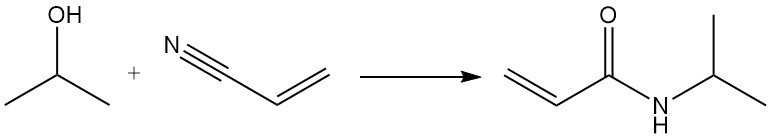
La reazione di Ritter dell’isopropanolo con l’acrilonitrile produce N-isopropilacrilammide:
L’alcol isopropilico può anche condensarsi con composti aromatici come toluene e fenolo per formare derivati isopropossilati utilizzati come intermedi nella sintesi di resine, tensioattivi e prodotti chimici speciali.
3. Produzione industriale di isopropanolo
L’isopropanolo viene prodotto industrialmente attraverso due processi principali: l’idratazione indiretta e l’idratazione diretta del propene. Volumi minori si ottengono mediante idrogenazione dell’acetone.
La produzione su scala industriale di alcol isopropilico iniziò nel 1920 presso lo stabilimento petrolchimico di Bayway, nel New Jersey, della Standard Oil (Exxon). Nel 1921, la Union Carbide (Carbide and Carbon Chemicals Corporation) avviò la produzione a Clendenin, West Virginia. La Shell Oil Company iniziò le operazioni negli anni ’30 a Dominguez, in California. Queste aziende rimasero i principali produttori statunitensi fino alla metà degli anni ’90.
Il processo di idratazione indiretta, noto anche come processo con acido solforico, è stato storicamente l’unico metodo commerciale fino al 1951, quando la Imperial Chemical Industries (ICI) commissionò il primo processo di idratazione diretta commerciale.
Entrambi i metodi utilizzano propilene e acqua come materie prime. Il processo indiretto può gestire flussi di gas di scarico C3 di raffineria contenenti il 40-60% in peso di propilene, rendendolo adatto all’integrazione nelle raffinerie statunitensi. Il metodo di idratazione diretta è stato sviluppato per superare i problemi di corrosione, elevato consumo energetico ed emissioni atmosferiche associati al metodo indiretto; tuttavia, richiede propilene ad elevata purezza.
Altri potenziali metodi di sintesi includono la fermentazione dei carboidrati, l’ossidazione del propano e l’idrolisi dell’acetato di isopropile. Tra questi, l’idrogenazione dell’acetone, un sottoprodotto della produzione di fenolo, è l’unico processo alternativo di rilevanza commerciale.
3.1. Produzione di isopropanolo mediante idratazione indiretta del propilene
L’idratazione indiretta del propilene ad alcol isopropilico è un processo in due fasi che utilizza acido solforico concentrato come catalizzatore. Nella prima fase, avviene l’esterificazione per formare esteri solforici, principalmente isopropil idrogenosolfato, insieme a quantità minori di diisopropil solfato. Nella seconda fase, l’idrolisi di questi esteri produce isopropanolo e rigenera l’acido solforico.
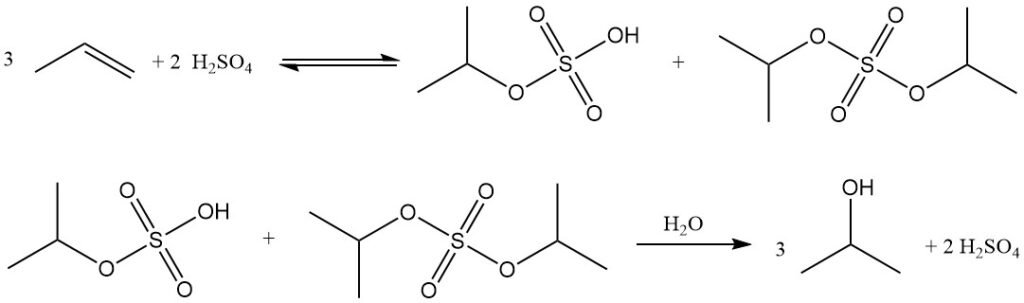
Il principale sottoprodotto di questo processo è l’etere diisopropilico (DIPE), formato dalla reazione di esteri solforici intermedi con isopropanolo. Altri sottoprodotti includono acetone (dalla decomposizione termica degli esteri solforici), ossido di mesitile, oligomeri di propilene (dimeri, trimeri) e alcoli minori come etanolo, 2-butanolo e n-propanolo provenienti dalle impurità di alimentazione.
Composti contenenti zolfo in combinazione con oligomeri insaturi possono causare odori sgradevoli, che vengono mitigati da condizioni di reazione ottimizzate e da un post-trattamento su metalli come rame o nichel.
La reazione viene condotta a 0,7–2,8 MPa e 20–80 °C utilizzando concentrazioni di acido solforico superiori al 60% in peso. Sono comuni due modalità operative:
- Il processo con acido forte è un’operazione in due fasi che utilizza >80% in peso di H2SO4 a 1–1,2 MPa e 20–30 °C.
- Il processo con acido debole è un’operazione in un’unica fase che utilizza 60–80% in peso di H2SO4 a circa 2,5 MPa e 60–65 °C.
Entrambi i processi raggiungono una selettività superiore al 98% in 2-propanolo e DIPE.
L’idrolizzato viene sottoposto a stripping per produrre una miscela di isopropanolo, DIPE e acqua di testa, con acido solforico diluito come residuo. Il DIPE viene generalmente riciclato nel reattore per l’idratazione. L’isopropanolo umido (87% in peso, 91% in volume) si ottiene dopo distillazione, con una conversione di propilene superiore al 93%. La disidratazione finale a grado anidro viene effettuata mediante distillazione azeotropica utilizzando DIPE o cicloesano come trascinatori.
Il controllo della corrosione richiede reattori in acciaio per l’acido concentrato a temperature moderate e in acciaio inossidabile, tantalio o Hastelloy per l’acido diluito a temperature più elevate. L’alcol isopropilico ad alta purezza o di grado “essenza” viene prodotto mediante post-trattamento su carbone attivo, setacci molecolari o letti fissi contenenti metalli, seguito da distillazione finale in apparecchiature non ferrose.
L’idratazione indiretta rimane la principale via commerciale negli Stati Uniti ed è praticata anche da diversi produttori europei e giapponesi.
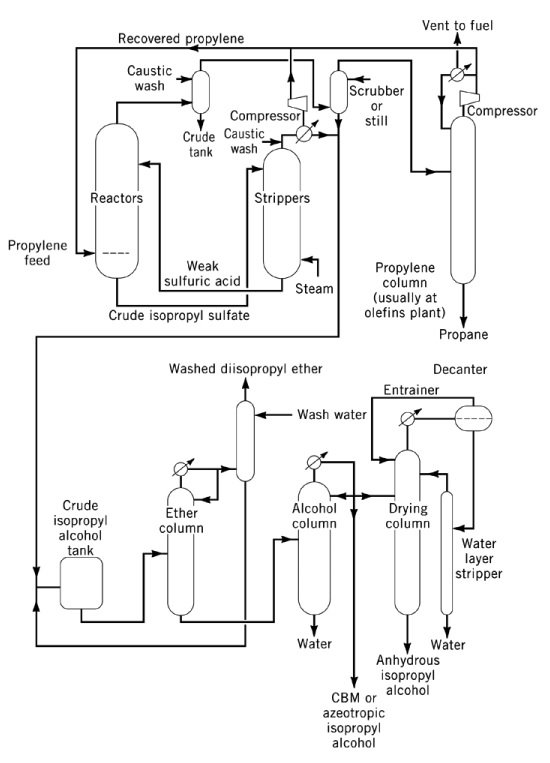
3.2. Produzione di isopropanolo mediante idratazione diretta del propilene
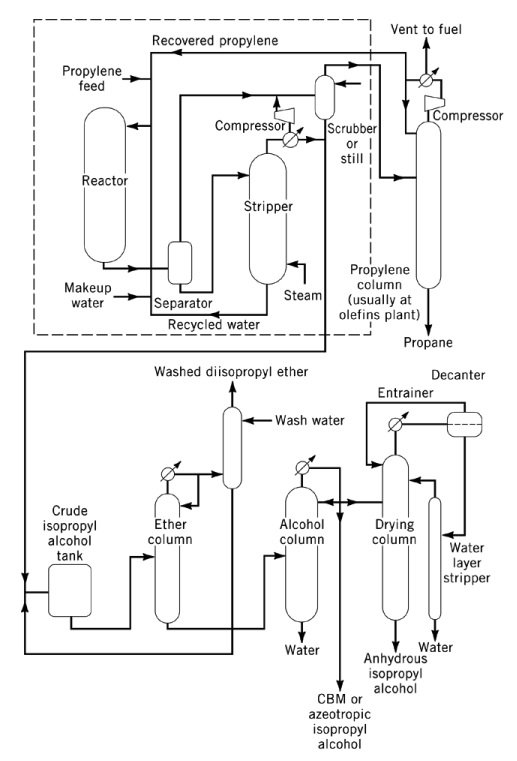
L’idratazione diretta del propilene a 2-propanolo è una reazione esotermica acido-catalizzata con un calore di reazione di -50 kJ/mol. Termodinamicamente, alte pressioni e basse temperature favoriscono la formazione di isopropanolo, sebbene la maggior parte dei catalizzatori richieda temperature da moderate ad alte per ottenere rese commerciali.
I processi di idratazione diretta commerciali sono classificati in tre tipologie principali: idratazione in fase vapore, idratazione mista vapore-fase liquido e idratazione in fase liquida.
Nei processi in fase vapore, come i processi Veba-Chemie e ICI, propilene e vapore acqueo vengono fatti passare su un catalizzatore acido a letto fisso. Il processo Veba-Chemie utilizza acido fosforico supportato su silice a 240–260 °C e 2,5–6,6 MPa per ottenere una selettività del 96% con una conversione del 5–6% per passaggio.
Il processo ICI utilizza un catalizzatore a base di ossido di tungsteno-ossido di zinco su silice a 230–290 °C e 20,3–25,3 MPa. In entrambi i casi, l’alta temperatura e il basso limite di conversione richiedono quindi un ampio riciclo del propilene. I requisiti di purezza della materia prima sono in genere intorno al 99% in peso.
L’idratazione in fase mista vapore-liquido, sviluppata da Deutsche Texaco AG, viene condotta in un reattore a letto percolatore utilizzando un catalizzatore a base di resina a scambio cationico con acido solfonico. La reazione avviene a 130–160 °C e 8–10 MPa con un rapporto molare propilene/acqua di 1:12–15.
Questo processo raggiunge una conversione superiore al 75% per passaggio e una selettività del 93% quando la purezza della materia prima è almeno del 92% in peso. I sottoprodotti formati durante la reazione includono circa il 5% di etere diisopropilico (DIPE) e piccole quantità di alcoli oligomerici superiori. La durata del catalizzatore supera gli otto mesi in condizioni operative normali.
L’idratazione in fase liquida, sviluppata da Tokuyama Soda, utilizza un catalizzatore silicotungstato acquoso debolmente acido a 270 °C e 20,3 MPa. Il processo produce una conversione del 60-70% per passaggio con una selettività del 98-99% molare.
Il catalizzatore viene riciclato con perdite minime e il processo presenta una bassa corrosione ed emissioni trascurabili. La purezza della materia prima è del 95% in peso o superiore. L’isopropanolo grezzo, ottenuto per distillazione azeotropica, contiene l’88% in peso di isopropanolo e viene successivamente purificato fino a raggiungere una purezza superiore al 99,99%.
I catalizzatori utilizzati nell’idratazione diretta sono acidi forti in grado di protonare il propilene per formare un carbocatione secondario. Tra gli esempi figurano acido fosforico supportato, ossido di tungsteno, acido molibdofosforico, ossido di titanio, ossido di zinco, ossido di zirconio, silicotungstati, ossalato di molibdeno e varie zeoliti.
Le resine a scambio ionico fortemente acide sono preferite per il funzionamento a temperature moderate. Alcuni anioni poliacidi, come il fosfomolibdato e il fosfotungstato, hanno dimostrato di migliorare la velocità di idratazione rispetto al solfato o al fosfato, probabilmente a causa di specifici effetti di associazione ionica con il carbocatione.
Il meccanismo di reazione prevede la protonazione del propilene per generare uno ione carbonio secondario, seguito dall’attacco nucleofilo dell’acqua per produrre alcol isopropilico protonato, che successivamente deprotona per formare l’alcol neutro. La velocità di reazione è proporzionale alla concentrazione dello ione idronio e indipendente dal controanione, sebbene gli anioni poliacidi possano accelerarla.
Da un punto di vista termodinamico, la costante di equilibrio in fase vapore è data da log K = 2624/T- 7,584, e in fase liquida l’energia libera standard è ΔF° = 23,25T- 9352 (dove T è espresso in K).
Le basse temperature riducono la formazione di DIPE, ma l’attività del catalizzatore ne stabilisce un limite inferiore pratico. Le alte pressioni aumentano la concentrazione dell’alcol e riducono la necessità di un riciclo intensivo del propilene.
3.3. Produzione di isopropanolo mediante idrogenazione dell’acetone
L’idrogenazione dell’acetone è impiegata negli Stati Uniti, in Russia, in Asia e in Sud America. Il processo può essere eseguito in fase liquida su un catalizzatore Raney a letto fisso e raggiunge una selettività del 99,9% e una conversione dell’acetone del 99,9%.
In alternativa, l’idrogenazione su un catalizzatore a base di ossido di rame-ossido di cromo a 120 °C e 196 kPa fornisce selettività inferiori, pari a circa il 98%, e conversioni pari a circa il 94%. Per questo processo non è richiesto acetone ad elevata purezza, il che lo rende particolarmente vantaggioso negli impianti in cui si genera acetone in eccesso come sottoprodotto, come nel processo cumene-fenolo.
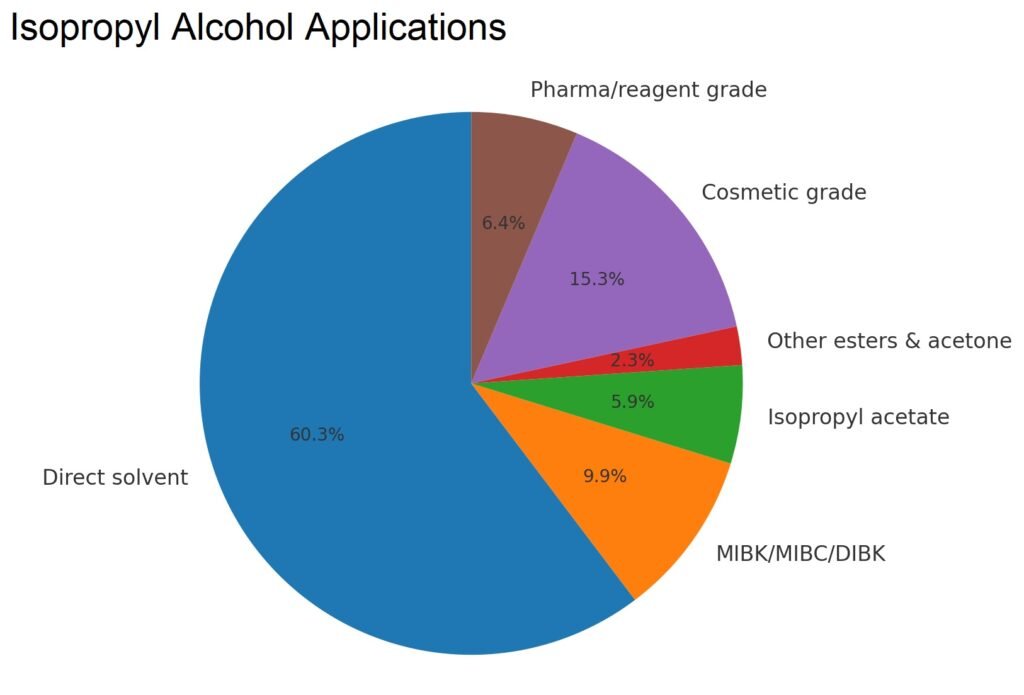
4. Applicazioni dell’isopropanolo
L’alcol isopropilico (isopropanolo) è utilizzato principalmente come solvente industriale, intermedio chimico e antisettico.
4.1. Usi dell’isopropanolo nell’industria chimica
I principali derivati chimici dell’isopropanolo includono il metilisobutilchetone (MIBK), il metilisobutilcarbinolo (MIBC), il diisobutilchetone (DIBK) e l’acetato di isopropile. Il 2-propanolo è anche una materia prima per la produzione di isopropilammine, utilizzate nella produzione di erbicidi e pesticidi. Una parte della diisopropilammina viene utilizzata nella sintesi del nitrato di diisopropilammonio, un inibitore di corrosione.
L’uso dell’alcol isopropilico per la produzione di acetone è diminuito significativamente a causa della diffusione del processo di ossidazione del cumene.
4.2. Usi dell’isopropanolo come solvente
Come solvente, l’alcol isopropilico presenta proprietà bilanciate di alcol, acqua e idrocarburi, che lo rendono efficace per sciogliere oli, gomme, cere, resine e alcaloidi. Viene utilizzato nella formulazione di cementi, primer, vernici, pitture, inchiostri da stampa, rivestimenti e processi di estrazione.
Nei prodotti cosmetici e per la cura della persona, viene utilizzato come solvente per lozioni, profumi, shampoo, detergenti per la pelle, smalti per unghie, struccanti, deodoranti e oli per il corpo, con l’aggiunta di fragranze per mascherarne l’odore.
Le formulazioni aerosol contenenti alcol isopropilico includono lacche per capelli, prodotti per la pulizia, insetticidi, antighiaccio per auto, deodoranti per ambienti, disinfettanti e vari spray per uso domestico e industriale.
4.3. Uso medico dell’isopropanolo
Nel settore farmaceutico, l’alcol isopropilico viene utilizzato come solvente di lavorazione e come antisettico e disinfettante attivo in ambienti domestici, ospedalieri e industriali. È più efficace dell’etanolo per il controllo microbico ed è ampiamente utilizzato in soluzioni acquose al 70% come alcol denaturato.
È presente anche in linimenti medicinali, tinture, tonici per il cuoio capelluto, bagni per suture chirurgiche e soluzioni per medicazioni, nonché in formulazioni come la tintura di iodio e il sapone verde.
4.4. Altri usi
L’alcol isopropilico ad alta purezza (99,99%) viene utilizzato nell’industria elettronica per la pulizia di dispositivi a integrazione su larga scala (LSI) e wafer di silicio. Ulteriori applicazioni includono il suo utilizzo come potenziatore di ottano, additivo antighiaccio per carburatori e cosolvente con metanolo nelle miscele di benzina.
Nei processi di estrazione, le soluzioni acquose di alcol isopropilico vengono utilizzate per l’estrazione liquido-liquido di acidi grassi da oli vegetali a basse temperature.
I dati sui consumi negli Stati Uniti riportati nella Tabella 3 mostrano gli usi principali dell’isopropanolo in solventi, rivestimenti, derivati chimici, cosmetici, prodotti farmaceutici e applicazioni speciali, con tendenze che indicano un calo nella produzione di acetone e isopropilammina, ma un uso stabile nei cosmetici, nei prodotti farmaceutici e nei solventi ad alte prestazioni.
| Anno | |||
|---|---|---|---|
| 2002 | 2008 | 2014 | |
| Solvente diretto | 243 | 269 | 237 |
| Derivati chimici | |||
| MIBK/MIBC/DIBK | 71 | 45 | 39 |
| Isopropilammine | 85 | 50 | – |
| Acetato di isopropile | 24 | 17 | 23 |
| Altri esteri e acetone | 17 | 17 | 9 |
| Qualità cosmetica | 52 | 56 | 60 |
| Farmaceutico (grado USP)/grado reagente | 21 | 25 | 25 |
| Totale | 513 | 479 | 393 |
5. Tossicologia dell’isopropanolo
L’isopropanolo è ampiamente presente in prodotti per la casa e industriali, tra cui alcol denaturato, disinfettanti, detergenti, cosmetici, prodotti farmaceutici e solventi. La sua tossicità è superiore a quella dell’etanolo, circa il doppio, ma inferiore a quella del metanolo. La principale via di esposizione è l’ingestione, con casi meno frequenti di inalazione o esposizione cutanea.
L’alcol isopropilico viene rapidamente assorbito dopo l’ingestione, con picchi di concentrazione plasmatica entro 30 minuti. È ampiamente distribuito nell’acqua corporea, con un volume di distribuzione di 0,45-0,55 L/kg.
Il metabolismo avviene principalmente nel fegato ad opera dell’alcol deidrogenasi, che lo converte in acetone, acetolo, metilgliossale, glicole propilenico, acetato e formiato, con successiva conversione in glucosio e altri prodotti metabolici.
L’acetone è il principale metabolita e compare nell’alito entro 15 minuti dall’ingestione. L’eliminazione avviene principalmente per via renale, con il 20% escreto immodificato e il resto sotto forma di acetone e suoi metaboliti. L’emivita di eliminazione dell’alcol isopropilico è di 2,5-8 ore, mentre l’eliminazione dell’acetone è più lenta, con un’emivita di 7,7-27 ore.
Il meccanismo di tossicità è prevalentemente la depressione del tronco encefalico causata sia dall’alcol isopropilico che, in misura minore, dall’acetone. Le caratteristiche cliniche variano da una lieve intossicazione a una grave depressione del sistema nervoso centrale (SNC) e respiratoria, collasso circolatorio, shock e coma. I sintomi precoci includono atassia, vomito, dolore addominale ed ematemesi, che nei casi gravi progrediscono fino a ipotensione, ipotermia e perdita dei riflessi.
A differenza del metanolo e del glicole etilenico, l’alcol isopropilico e l’acetone non causano acidosi metabolica con gap anionico elevato, ma producono chetonemia, chetonuria e un gap osmolare elevato. L’alito emana un odore fruttato caratteristico.
La dose tossica di alcol isopropilico al 70% è di circa 1 ml/kg e l’ingestione di 100-250 ml può essere fatale. La morte è causata da paralisi del sistema nervoso centrale. L’inalazione di elevate concentrazioni di vapore può causare effetti anestetici e lieve irritazione di occhi, naso e gola.
I limiti di esposizione professionale sono stabiliti da OSHA e ACGIH a 400 ppm (8-h TWA) e 500 ppm (STEL). La soglia di odore varia da 3 a 200 ppm. L’uso industriale in condizioni normali non rappresenta un rischio significativo per la salute.
Studi su animali, inclusi test di inalazione subcronica, neurotossicità, sviluppo, riproduzione e oncogenicità, non hanno dimostrato effetti avversi.
La diagnosi di avvelenamento da isopropanolo si basa sull’anamnesi di esposizione, sui riscontri clinici e sui risultati di laboratorio che mostrano un gap osmolare con chetosi in assenza di acidosi metabolica. La misurazione dei livelli sierici di alcol isopropilico può confermare l’esposizione, ma non è sempre disponibile.
La gestione dell’avvelenamento da isopropanolo è principalmente di supporto al mantenimento delle funzioni vitali, tra cui la protezione delle vie aeree, la stabilizzazione cardiovascolare (per affrontare una potenziale ipotensione) e il monitoraggio dell’equilibrio acido-base ed elettrolitico del paziente. Il carbone attivo è inefficace in questo tipo di avvelenamento e pertanto non è raccomandato.
L’emodialisi migliora l’eliminazione sia dell’alcol isopropilico che dell’acetone, ma è generalmente riservata ai casi gravi e potenzialmente letali con grave ipotensione, coma o concentrazioni sieriche molto elevate. La maggior parte dei pazienti guarisce completamente con una tempestiva terapia di supporto.
Riferimenti
- Klabunde, J., Bischoff, C. and Papa, A.J. (2025). Propanols. In Ullmann’s Encyclopedia of Industrial Chemistry. https://doi.org/10.1002/14356007.a22_173.pub3
- Logsdon, J.E. and Loke, R.A. (2000). Isopropyl Alcohol. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0919151612150719.a01
- Jolliff, H.A. (2017). Isopropyl Alcohol. In: Brent, J., et al. Critical Care Toxicology. Springer, Cham. https://doi.org/10.1007/978-3-319-17900-1_53
- Co, I. N.; Gunnerson, K. J. Chapter 71 – Iatrogenic and Poison-Derived Acid Base Disorders. In Critical Care Nephrology, 3rd ed.; Ronco, C., Bellomo, R., Kellum, J. A., Ricci, Z., Eds.; Elsevier, 2019; pp 417-423.e2. DOI: 10.1016/B978-0-323-44942-7.00071-6
- Gwaltney-Brant, S. M. Chapter 24 – Miscellaneous Indoor Toxicants. In Small Animal Toxicology, 3rd ed.; Peterson, M. E., Talcott, P. A., Eds.; W.B. Saunders, 2013; pp 291-308. DOI: 10.1016/B978-1-4557-0717-1.00024-7
- Slaughter, R. J., Mason, R. W., Beasley, D. M. G., Vale, J. A., & Schep, L. J. (2014). Isopropanol poisoning. Clinical Toxicology, 52(5), 470–478. https://doi.org/10.3109/15563650.2014.914527
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Chemical Agents and Related Occupations. Lyon (FR): International Agency for Research on Cancer; 2012. (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 100F.) ISOPROPYL ALCOHOL MANUFACTURE BY THE STRONG-ACID PROCESS. Available from: https://www.ncbi.nlm.nih.gov/books/NBK304434/
- Carls, R.-R.; Osterburg, G.; Prezelj, M.; Webers, W. “Process for the production of isopropyl alcohol.” U.S. Patent 4,760,203, 1988. Available from: https://patents.google.com/patent/US4760203A/en
- Hirata, S.; Ogawa, S. “Process for producing isopropyl alcohol.” U.S. Patent 5,763,693, 1998. Available from: https://patents.google.com/patent/US5763693A/en
- Gershbein, L. L.; Pines, H.; Ipatieff, V. N. “Reactions of Isopropyl Alcohol in the Presence of Catalysts Containing Magnesium Oxide.” J. Am. Chem. Soc., 1947, 69 (11), 2888–2893. DOI: 10.1021/ja01203a074
