Acido nitrilotriacetico: proprietà, produzione, usi e tossicologia
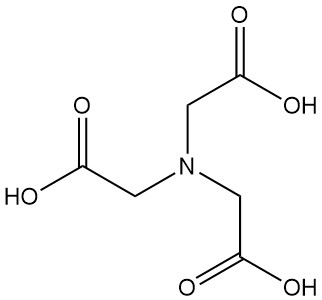
Cos’è l’acido nitrilotriacetico?
L’acido nitrilotriacetico, noto anche come NTA o N,N-bis(carbossimetil)glicina, è un acido tricarbossilico con formula C6H9NO6. È un solido incolore che appartiene alla famiglia degli acidi amminopolicarbossilici ed è uno degli agenti chelanti più importanti, insieme all’EDTA.
Fu sintetizzato per la prima volta nel 1861 da Heintz facendo reagire l’ammoniaca con l’acido cloroacetico. La produzione industriale su larga scala iniziò a Ludwigshafen nel 1936. Da allora, l’acido nitrilotriacetico si è affermato come agente chelante utilizzato in vari processi industriali.
Sommario
1. Proprietà fisiche dell’acido nitrilotriacetico
L’acido nitrilotriacetico è un triacido che forma cristalli incolori aghiformi quando cristallizzato da una soluzione acquosa. È insolubile in acqua e nella maggior parte dei solventi organici; tuttavia, i nitrilotriacetati di metalli alcalini presentano un’elevata solubilità in acqua. Ad esempio, il nitrilotriacetato di trisodio si dissolve fino a 640 g/L in acqua.
Le proprietà fisiche più importanti dell’acido nitrilotriacetico sono presentate nella tabella seguente.
| Proprietà | Valore |
|---|---|
| Numero CAS | [139-13-9] |
| Formula chimica | C6H9NO6 |
| Massa molecolare | 191,14 g/mol |
| Punto di fusione | 242 °C (decomposizione) |
| Acqua Solubilità | 0,13 g/100 g a 5 °C 0,13 g/100 g a 22,5 °C 0,95 g/100 g a 80 °C 3,3 g/100 g a 100 °C |
| pH della soluzione satura | 2,3 |
| pK1 a 25 °C | 1,80 |
| pK2 a 25 °C | 2,48 |
| pK3 a 25 °C | 9.65 |
2. Proprietà chimiche dell’acido nitrilotriacetico
L’acido nitrilotriacetico (NTA) è caratterizzato principalmente dalla formazione di chelati idrosolubili con cationi metallici multivalenti. Sia i gruppi carbossilici che l’azoto terziario fungono da siti di ligando. Le posizioni di coordinazione degli ioni metallici non occupate possono essere occupate da molecole d’acqua.
Mentre la geometria ottaedrica (numero di coordinazione 6) spesso rappresenta i chelati metallo-NTA, recenti studi strutturali mediante diffrazione dei raggi X indicano la possibilità di numeri di coordinazione più elevati in alcuni complessi metallici. Ad esempio, Ca2+ nel complesso CaNTA– mostra un numero di coordinazione pari a 7.
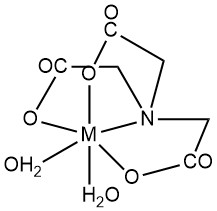
In generale, i complessi metallici si formano in un rapporto molare metallo/NTA di 1:1, e un eccesso di NTA può portare a complessi 1:2. Le costanti di stabilità (K1 per 1:1, K2 per 1:2) quantificano la stabilità del complesso. La polarizzazione del legame H-O nel chelato conferisce ai complessi 1:1 una proprietà di acido debole, caratterizzata dalla costante di dissociazione Kd.
K1 = [MNTA]/[M][NTA]
K2 = [MNTA2]/[M][NTA]2
Kd = [MNTAOH][H+]/[MNTA]
Dove M è lo ione metallico multivalente, NTA rappresenta l’anione N(CH2COO–)3.
La Tabella 2 elenca alcune delle costanti di stabilità per i chelati NTA.
| Ione metallico | log K1 | log K2 | pKd |
|---|---|---|---|
| Al3+ | 11,4 | - | 5,09 |
| Ca2+ | 6,39 | 8,76 | - |
| Cd2+ | 9,78 | 14,39 | 11,25 |
| Co2+ | 10,38 | 14,33 | 10,80 |
| Cu2+ | 12,94 | 17,42 | 9,14 |
| Fe2+ | 8,33 | 12,80 | 10,60 |
| Fe3+ | 15,90 | 24,30 | 4,1-7,8 |
| Hg2+ | 14,60 | - | - |
| Mg2+ | 5,47 | - | - |
| Mn2+ | 7,46 | 10,94 | - |
| Ni2+ | 11,50 | 16,32 | 10,86 |
| Pb2+ | 11,34 | - | - |
| Zn2+ | 10,66 | 14.24 | 10.06 |
La complessazione dell’acido nitrilotriacetico con metallo compete con altre reazioni. I cationi metallici possono formare precipitati scarsamente solubili con anioni come carbonato, solfuro, solfato o ossalato. Inoltre, gli ioni idrogeno competono con i cationi metallici per i siti di legame dei trianioni nitrilotriacetici. Di conseguenza, i sistemi dell’acido nitrilotriacetico sono controllati da equilibri multipli.
I chelati di nitrilotriacetato sono stabili in un ampio intervallo di pH che dipende dalla concentrazione del chelato e dall’eccesso di agente complessante; ad esempio, Ca2+ (pH 9–12), Mg2+ (pH 7–10), Cu2+ (pH 3–12) e Fe2+ (pH 1,5–3).
3. Produzione di acido nitrilotriacetico
La produzione storica di acido nitrilotriacetico da ammoniaca e acido cloroacetico non è più utilizzata. L’ossidazione della trietanolammina non ha più rilevanza industriale.
Oggi, l’acido nitrilotriacetico viene prodotto mediante processi di cianometilazione acida alcalina a uno stadio o a due stadi, utilizzando ammoniaca (o solfato di ammonio), formaldeide e cianuro di sodio (o acido cianidrico).
3.1. Il processo alcalino
Il processo alcalino è un processo consolidato in cui il nitrilotriacetato di trisodio viene prodotto dalla reazione di ammoniaca, formaldeide e cianuro di sodio. L’idrolisi del nitrilotriacetato produce il sale di nitrilotriacetato.
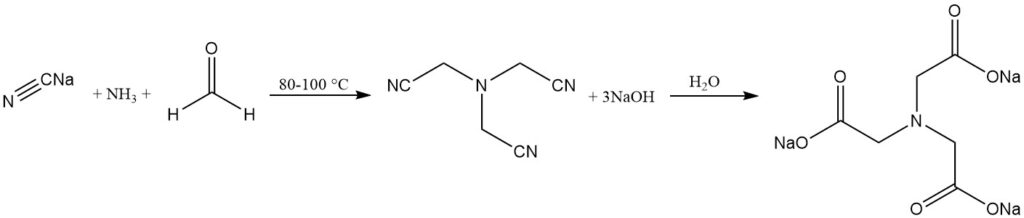
NH3 + 3 HCHO + 3 NaCN → N(CH2CN)3 + 3 NaOH
N(CH2CN)3 + 3 NaOH + 3 H2O → N(CH2COONa)3 + 3 NH3
Questo processo può essere condotto in batch o in continuo e avviene a 80-100 °C. A pH elevato (circa 14), la triscianometilammina viene idrolizzata in situ a nitrilotriacetato di trisodio.
In un processo industriale continuo, una soluzione acquosa di cianuro di sodio viene immessa in un sistema di reattori a cascata insieme a una soluzione di formaldeide. Questo metodo genera un eccesso di ammoniaca pari a tre volte la quantità totale, che deve essere limitato per evitare la produzione di sottoprodotti con bassi gradi di carbossimetilazione, come glicina e acido imminodiacetico.
L’eliminazione dell’ammoniaca in eccesso durante il processo viene effettuata distillando continuamente l’ammoniaca con vapore o aria durante tutto il processo; tuttavia, la formazione di piccole quantità di prodotti indesiderati come l’acido glicolico e altri menzionati in precedenza è inevitabile.
La soluzione finale viene venduta al 40%, convertita in polvere o acidificata per formare acido nitrilotriacetico.
3.2. Il processo acido
Per limitare la formazione di sottoprodotti nel processo alcalino, alcuni produttori hanno costruito impianti basati sul processo acido; tuttavia, questo metodo richiede rigorosi protocolli di sicurezza a causa dell’uso di acido cianidrico, oltre al problema della corrosione.
In primo luogo, ammoniaca e formaldeide producono esametilentetrammina, che successivamente reagisce con acido cianidrico in acido solforico per formare triscianometilammina.
La triscianometilammina solida è insolubile nel mezzo di reazione, quindi viene filtrata, lavata e quindi saponificata con idrossido di sodio per ottenere una soluzione di nitrilotriacetato di trisodio con una quantità minima di sottoprodotti.
Questa soluzione viene anche venduta come prodotto al 40% o utilizzata nella produzione di acido nitrilotriacetico in polvere o solido.
L’acido nitrilotriacetico commerciale è disponibile con diversi nomi commerciali, tra cui Dissolvine A (Akzo), Masquol NTA (Protex), Rexene NTA (Akzo), Trilon A (BASF) e Versene NTA (Dow).
4. Usi dell’acido nitrilotriacetico
L’uso principale dell’acido nitrilotriacetico e dei suoi sali si basa sulla loro capacità di formare complessi con ioni metallici. Queste proprietà di complessazione sono utilizzate in diversi campi per sequestrare ioni metallici interferenti, dissolvere precipitati, modulare i potenziali redox degli ioni metallici o creare tamponi per gli ioni metallici.
4.1. Usi dell’acido nitrilotriacetico nell’addolcimento dell’acqua
L’acido nitrilotriacetico addolcisce efficacemente l’acqua complessando gli ioni calcio (Ca2+) e magnesio (Mg2+) in un intervallo di pH da neutro ad alcalino. La quantità di acido nitrilotriacetico o nitrilotriacetato trisodico necessaria per l’addolcimento dell’acqua varia in base alla durezza dell’acqua.
Settori come quello cartario, tessile, del sapone, dei cosmetici, dei detergenti, del trattamento dell’acqua di alimentazione delle caldaie e dei processi chimici (ad esempio, fotografia, galvanica) utilizzano l’acido nitrilotriacetico per l’addolcimento dell’acqua.
4.2. Usi dell’acido nitrilotriacetico come sostituto del fosfato nei detergenti
Il nitrilotriacetato di trisodio viene utilizzato come sostituto del trifosfato pentasodico nei detergenti a basso contenuto di fosfati o privi di fosfati, spesso in combinazione con zeoliti o policarbossilati.
A differenza del trifosfato pentasodico, il nitrilotriacetato di trisodio resiste all’idrolisi e rimane pienamente efficace dopo l’essiccazione a spruzzo e durante il lavaggio. Sebbene il rapporto di equivalenza tra nitrilotriacetato di trisodio e trifosfato pentasodico sia di circa 0,6 a 1, non compromette la detergenza primaria o secondaria.
4.3. Usi dell’acido nitrilotriacetico come sostituto del difosfato tetrapotassico nei detergenti
Il nitrilotriacetato di trisodio sostituisce il difosfato tetrapotassico nei detergenti con un favorevole rapporto di equivalenza di 1:3, eliminando spesso la necessità di idrotropi o solubilizzanti. Effetti sinergici di builder si verificano con la sostituzione parziale del fosfato.
4.4. Usi dell’acido nitrilotriacetico nel mascheramento degli ioni di metalli pesanti
Sebbene meno efficace dell’EDTA, l’acido nitrilotriacetico viene utilizzato per mascherare gli ioni di metalli pesanti come Fe3+, Cu2+ e Mn2+. Industrie come la produzione di sapone, lo sbiancamento tessile, la pulizia delle superfici e vari processi chimici lo utilizzano a questo scopo.
4.5. Applicazioni specializzate
L’acido nitrilotriacetico viene utilizzato anche in applicazioni specializzate come la separazione di elementi delle terre rare, le titolazioni complessometriche e la formulazione di micronutrienti in agricoltura.
5. Tossicologia dell’acido nitrilotriacetico
L’acido nitrilotriacetico è altamente biodegradabile e mineralizza facilmente in prodotti finali inorganici senza metaboliti organici persistenti.
Studi ambientali, in particolare a seguito dell’introduzione di detergenti contenenti acido nitrilotriacetico, ne confermano la rapida biodegradazione negli impianti di trattamento delle acque reflue (>98%) e nelle acque superficiali (emivita < 1 giorno). Tracce minime di acido nitrilotriacetico sono rilevabili nelle acque sotterranee dopo infiltrazione limitata.
Sebbene la capacità complessante dell’acido nitrilotriacetico possa potenzialmente mobilizzare metalli pesanti, la sua rapida biodegradazione riduce al minimo questo rischio. Studi condotti su impianti di trattamento delle acque reflue e sedimenti fluviali indicano una rimobilizzazione trascurabile dei metalli pesanti in condizioni realistiche.
L’acido nitrilotriacetico dimostra una bassa tossicità acuta per gli organismi acquatici, con valori di LC50 che vanno da circa 100 a oltre 10.000 mg/L, influenzati dalla durezza dell’acqua. Studi di tossicità cronica su vari organismi non rivelano effetti avversi al di sotto di 1 mg/L, con soglie di tossicità significative a concentrazioni molto più elevate.
La tossicità acuta nei mammiferi varia a seconda della specie. Il valore di LD50 orale per il nitrilotriacetato di trisodio nei roditori è di circa 2000 mg/kg; questa dose induce vomito in cani e scimmie.
Studi sull’inalazione e test di irritazione cutanea/oculare/delle vie respiratorie mostrano effetti minimi, senza indicazioni di sensibilizzazione o allergia. L’acido nitrilotriacetico non ha effetti teratogeni, da solo o in combinazione con metalli pesanti come cadmio e mercurio. Inoltre, i test di mutagenicità danno risultati negativi.
I mammiferi non metabolizzano l’acido nitrilotriacetico; invece, i reni lo espellono immodificato. Le cellule dei tubuli renali e degli ureteri accumulano concentrazioni più elevate di acido nitrilotriacetico.
Studi subcronici e cronici collegano l’acido nitrilotriacetico alla tossicità renale dovuta a disturbi del metabolismo degli elettroliti e del ferro. Dosi elevate possono danneggiare le cellule epiteliali di reni, uretere e vescica, portando potenzialmente alla formazione di tumori.
Tuttavia, esiste una soglia significativa al di sotto dello sviluppo tumorale, che supera di gran lunga la soglia senza effetti avversi (NOEL) di 14 mg/kg di peso corporeo al giorno.
Riferimento
- Nitrilotriacetic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_377.pub3
Sono un chimico organico appassionato e continuo ad apprendere su vari processi di chimica industriale e prodotti chimici. Garantisco che tutte le informazioni su questo sito web siano accurate e meticolosamente referenziate ad articoli scientifici.
