Cloroacetaldeide: proprietà, produzione e usi

La cloroacetaldeide [107-20-0], nota anche come 2-cloroetanale, è un composto organico con formula CH2ClCHO. È un liquido incolore che è stato prodotto per la prima volta in forma pura da K. Natterer nel 1882 riscaldando la cloroacetaldeide dietil acetale con acido ossalico anidro a 100–150 °C.
Sommario
1. Proprietà fisiche della cloroacetaldeide
1.1. Cloroacetaldeide anidra
La cloroacetaldeide anidra è un liquido incolore e mobile con un odore pungente che ha le seguenti proprietà fisiche:
- Peso molecolare: 78,50 g/mol
- Punto di ebollizione: 85–85,5 °C (99,7 kPa)
- Entalpia di formazione: -256,4 kJ/mol
- Entalpia di combustione: -981,4 kJ/mol (101,3 kPa, 20 °C)
- Momento di dipolo: 1,99 D (298 K, benzene)
- Solubile in acqua (formazione di idrato) e comuni solventi organici
- Coefficiente di ripartizione ottanolo-acqua: 0,16 (molto basso)
1,2. Monocloroacetaldeide emiidrata
- Formula: CH2ClCH(OH)2OCH(OH)CH2Cl (1,1′-diidrossi-2,2′-diclorodietil etere)
- Peso molecolare: 175,01 g/mol
- Cristalli incolori con punto di fusione tra 43 e 50 °C (disidratazione)
- Si decompone al punto di ebollizione (84 °C)
- Solubile in acqua, etanolo, etere, benzene, diclorometano e cloroformio.
- I numeri CAS [34789-09-8] (“acetaldeide cloro dimero idrato”) e [7737-02-2] (“1,1′-ossibis(2-cloroetanolo)”) si riferiscono allo stesso composto.
- Forma una miscela azeotropica con acqua, inseparabile per semplice distillazione.
- Punto di infiammabilità: 60 °C
- Punto di accensione: 405 °C
- Limiti di esplosività in aria (20 °C, 101,3 kPa): inferiore 305 g/m³
| Temperatura (°C) | Solubilità (% in peso) |
|---|---|
| 1 | 13,35 |
| 10 | 22,2 |
| 20 | 44,3 |
| 30 | 62,7 |
| 40 | 81,5 |
| Concentrazione (% in peso) | Densità (g/cm³) |
|---|---|
| 10 | 1,041 |
| 20 | 1,085 |
| 30 | 1,137 |
| 40 | 1,188 |
| 50 | 1,238 |
| 60 | 1,290 |
| 72,5 | 1,355 |
2. Proprietà chimiche della cloroacetaldeide
La cloroacetaldeide è molto reattiva a causa sia dei gruppi aldeidici che clorometilici. I suoi α-idrogeni e il cloro vengono attivati, facilitando le sostituzioni nucleofile e le reazioni tipiche delle aldeidi (addizione, condensazione).
2.1. Reazioni del gruppo aldeidico
L’autocondensazione della cloroacetaldeide a temperatura ambiente forma trimeri ciclici, tetrameri e polimeri di poliossimetilene. Esistono anche cotrimeri e copolimeri con acetaldeide. La struttura dell’etere 1,1′-diidrossi-2,2′-diclorodietilico emiidrato reagisce in modo simile a un’aldeide.
L’addotto di bisolfito di sodio e gli acetali dimetilici/dietilici sono importanti derivati della cloroacetaldeide utilizzati come precursori farmaceutici e pesticidi.
L’ossidazione della cloroacetaldeide con aria/sali di cobalto, perossido di idrogeno o acido nitrico produce acido monocloroacetico.

La condensazione aldolica in un mezzo alcalino produce 2,4-dicloroacetaldolo, mentre la coaldolizzazione con acetaldeide forma 2-clorocrotonaldeide, che è anch’essa un sottoprodotto della produzione di acetaldeide.
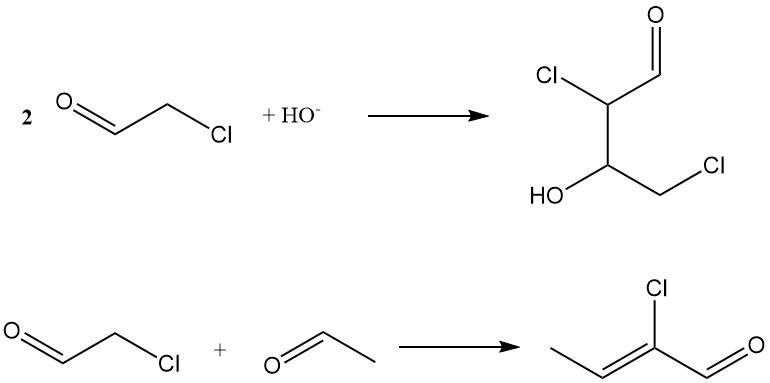
Altre reazioni includono la formazione di aldeide ammoniaca, cianidrina e 2-cloroetil cloroacetato (reazione di Tishchenko).
2.2. Reazioni dell’atomo di cloro
L’idrogenazione della cloroacetaldeide in una soluzione acquosa con un catalizzatore palladio-carbonio rimuove il cloro. Vari nucleofili possono sostituire il cloro.
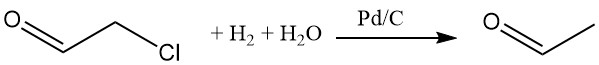
La cloroacetaldeide reagisce con il mercaptano sodico per produrre mercaptoacetaldeide, utilizzata come intermedio nella sintesi di tienodiazepine, coloranti azoici, d-l-cisteina e alcuni aromi alimentari.

I composti amminici possono sostituire l’atomo di cloro della cloroacetaldeide in forma acetalica (evitare reazioni con il gruppo aldeidico). Questi intermedi sono utilizzati nella sintesi di pesticidi e prodotti farmaceutici.

La cloroacetaldeide dimetil acetale reagisce con il metossido di sodio per formare 1,1,2-trimetossietano (un intermedio farmaceutico).

2.3. Reazioni combinate
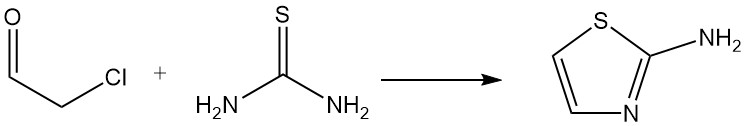
La cloroacetaldeide (emiidrato o acetale) è un importante materiale di partenza per la sintesi di eterocicli; un esempio è la reazione con la tiourea per formare 2-amminotiazolo, che viene utilizzato nella produzione di prodotti farmaceutici e coloranti.
La ciclocondensazione con metil acetoacetato produce 2-metil-3-carbometossifurano (un disinfettante per semi).
La reazione della cloroacetaldeide con carboetossiidrazina, seguita dalla ciclizzazione con cloruro di tionile, produce 5-clorotiadiazolo, un defoliante del cotone e regolatore della crescita delle piante.
Gli stilbeni si formano tramite reazioni con idrocarburi aromatici, fenoli o eteri fenolici. I vinil dialchil fosfati sono prodotti dalla reazione di Perkow con trialchil fosfiti. L’1,1,2-triacetossietano (precursore della d,l-serina) si prepara tramite reazione della cloroacetaldeide con acetato di sodio e anidride acetica.
2.4. Polimeri di cloroacetaldeide
1. Tricloroparaldeide (C6H9Cl3O3)
- Proprietà: cristalli incolori, punto di fusione 88–89 °C, punto di ebollizione 140–144 °C, solubili nei comuni solventi organici.
- Formazione:
- Reazione di acido solforico concentrato con cloroacetaldeide emiidrata.
- Residuo della distillazione azeotropica di cloroacetaldeide emiidrata.
- Decomposizione del nitrato di 1,2-dicloroetile in presenza di acidi di Lewis.
Viene convertito in cloroacetaldeide riscaldandolo con acidi.
2. Tetraclorometaldeide (C8H12Cl4O4)
- Proprietà: cristalli incolori, punto di fusione 65–67 °C, punto di ebollizione 127–130 °C.
- Formazione: residuo della disidratazione azeotropica dell’emiidrato di cloroacetaldeide.
3. Policloroacetaldeidi (C2H3ClO)n
- Proprietà: prodotti elastomerici amorfi con struttura poliacetalica. Forme cristalline disponibili a temperature più basse con catalizzatori specifici.
- Formazione: polimerizzazione di cloroacetaldeide anidra da -40 a -78°C, in particolare con acidi di Lewis.
3. Produzione di cloroacetaldeide

La cloroacetaldeide è prodotta dalla reazione di acetaldeide o paraldeide con cloro, con dicloroacetaldeide e tricloroacetaldeide come impurità. Questi prodotti degli alberi sono anche ottenuti come sottoprodotti nel processo Wacker per la produzione di acetaldeide.
Un altro metodo di produzione è la clorurazione del cloruro di vinile in acqua a 20 °C, che produce una resa di cloroacetaldeide quasi del 100% se la sua concentrazione nel mezzo di reazione rimane al di sotto del 5%. Concentrazioni più elevate favoriscono la formazione di 1,1,2-tricloroetano.
La reazione del cloro con acetato di vinile in acqua a temperatura ambiente forma una soluzione concentrata di cloroacetaldeide, che può essere distillata per produrre il composto puro. I prodotti collaterali sono piccole quantità di acetaldeidi clorurate, acetaldeide e prodotti di condensazione.
La sintesi di acetali di cloroacetaldeide con rese elevate e purezza si ottiene conducendo le reazioni di cui sopra in alcoli.
La produzione di cloroacetaldeide anidra mediante clorurazione di acetaldeide o paraldeide secca fornisce una bassa resa. Tuttavia, la disidratazione azeotropica dell’emiidrato con cloroformio, toluene o tetracloruro di carbonio seguita da distillazione su un agente disidratante offre risultati migliori.
La cloroacetaldeide anidra si ottiene con rese elevate mediante depolimerizzazione di tricloroparaldeide o policloroacetaldeide a 145 °C con acido ossalico o tricloroacetico. Anche la pirolisi del carbonato di cloroetilene in presenza di sali di ammonio quaternario fornisce lo stesso risultato.
4. Utilizzi della cloroacetaldeide
La cloroacetaldeide è utilizzata come elemento costitutivo nella produzione di intermedi per farmaci statinici, che abbassano i livelli di colesterolo, e per farmaci anti-AIDS. Il derivato mercapto, 2,5-diidrossi-1,4-ditiano, è utilizzato nella sintesi di farmaci contro HIV/AIDS.
La cloroacetaldeide è utilizzata anche nella sintesi di vari coloranti. I suoi derivati dialchilacetalici, come la cloroacetaldeide dimetil acetale, sono importanti materiali di partenza per la produzione di prodotti chimici agricoli e i suoi acetali sono utilizzati nella produzione di fragranze.
Può formare polimeri, che non sono commercialmente importanti.
5. Tossicologia della cloroacetaldeide
Tossicità acuta:
- Altamente tossico per inalazione, causa una morte rapida o ritardata negli animali. I valori della dose letale (LD50) sono:
- Ratto (orale): 89 mg/kg
- Coniglio (cutaneo): 267 mg/kg
- Ratto (inalazione, 1 ora): 650 mg/m³
- Irritante per la pelle e gli occhi, anche a basse concentrazioni (soluzione allo 0,03%).
- Non è un sensibilizzante cutaneo nelle cavie.
Tossicità cronica:
- Non sono stati osservati segni di tossicità negli studi di inalazione cronica al di sotto di 5,2 mg/m³.
- Mutageno in vari organismi e cellule umane.
- Non è stato osservato alcun aumento dei tumori cutanei negli studi sui topi.
- Sono stati osservati tumori al fegato nei topi maschi che bevevano acqua con 0,1 g/L di cloroacetaldeide.
Esposizione umana:
- La cloroacetaldeide è un irritante per la pelle, le mucose e le vie respiratorie.
- Provoca vesciche simili a ustioni e danni ai tessuti a contatto con la pelle.
- Lacrimazione e irritazione nasale a 32,6 mg/m³ di esposizione all’aria.
Raccomandazioni:
- TLV-STEL (USA): 1 ppm (massima concentrazione consentita nell’aria).
- Classificazione UE: “Molto tossico” e “Pericoloso per l’ambiente”.
- Richiede un equipaggiamento di protezione individuale completo (occhiali, guanti e maschera).
Riferimento
- Chloroacetaldehydes; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_527.pub2
