Dimethylamine: eigenschappen, reacties, productie en toepassingen
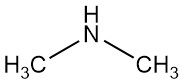
Dimethylamine is een organische verbinding met de formule (CH3)2NH. Het is een kleurloos, ontvlambaar gas met een ammoniakachtige geur, hoewel het bij lage concentraties naar vis kan ruiken, en de geur is krachtiger dan methylamine en minder dan trimethylamine.
Dimethylamine wordt commercieel vaak aangetroffen als een oplossing in water in concentraties tot ongeveer 40%.
Inhoudsopgave
1. Fysieke eigenschappen van dimethylamine
Dimethylamine is een schadelijk, kleurloos gas of samengeperste vloeistof die zeer ontvlambaar is en een zeer sterke vis- of ammoniakachtige geur heeft. Het is oplosbaar in water en wordt verkocht als waterige oplossingen of in zuivere vorm.
Bij het afkoelen van waterige oplossingen van dimethylamine wordt het kristallijne hydraat (CH3)2NH·7 H2O gevormd. Dimethylamine is oplosbaar in verschillende organische oplosmiddelen.
Waterige oplossingen van dimethylamine zijn goede oplosmiddelen voor veel anorganische en organische verbindingen; de potentiële reactiviteit van de opgeloste stof met dimethylamine moet echter in overweging worden genomen.
Tabel 1 geeft de fysieke eigenschappen van dimethylamine weer.
| Eigenschap | Waarde |
|---|---|
| Moleculair gewicht, g/mol | 45,08 |
| Kookpunt (101,33 kPa), °C | 6,8 |
| Smeltpunt, °C | -92,2 |
| Dichtheid bij 25 °C (vloeistof), g/cm3 | 0,6556 |
| pKa (bij 25 °C) | 10,77 |
| Breukindex bij 17 °C | 1,350 |
| Oppervlaktespanning (25 °C), 10-3 N/m | 16,33 |
| Verdampingswarmte bij 25 °C, kJ/mol | 23,663 |
| Smeltwarmte, kJ/mol | 5,945 |
| Standaardvormingswarmte, kJ/mol bij 25 °C (vloeistof) | -43,96 |
| Standaardvormingswarmte, kJ/mol bij 25 °C (gas) | -18,46 |
| Verbrandingswarmte, standaardtoestand bij 25 °C, vloeistof, kJ/mol | -1744,63 |
| Warmtecapaciteit, ideaal gas (25 °C), J K-1 mol-1 | 70,7 |
| Kritische temperatuur, °C | 164,5 |
| Kritische druk, MPa | 5,31 |
| Diëlektrische constante (25 °C), vloeistof | 5,26 |
| Dipoolmoment in benzeen (25 °C), D | 1,18 |
| Vlampunt (gesloten beker), °C | -57 |
| Ontstekingstemperatuur in lucht, °C | 400 |
| Onderste explosiegrens in lucht, vol % | 2,8 |
| Bovenste explosiegrens in lucht, vol % | 14,4 |
2. Chemische reacties van dimethylamine
Dimethylamine is basisch en reageert daarom met water en zuren om dimethylammoniumverbindingen te vormen. Door de aanwezigheid van elektronendonerende methylgroepen bezit dimethylamine een grotere basiciteit dan ammoniak.
Deze methylgroepen stabiliseren de positieve lading die tijdens protonering wordt gevormd. De basiciteit ervan blijft echter zwakker in vergelijking met hydroxide- en alkoxide-ionen.
Dimethylamine gedraagt zich als een nucleofiel vanwege de aanwezigheid van een ongedeeld elektronenpaar op het stikstofatoom. Dimethylamine reageert gemakkelijk met verschillende substraten, waaronder carbonzuren, acylhalogeniden, anhydriden, esters, lactonen, isocyanaten, α,β-onverzadigde nitrilen en esters, epoxiden, alkylhalogeniden, koolstofdioxide en koolstofdisulfide.
De reactie van dimethylamine met een organisch zuur of de ester van een organisch zuur leidt tot de vorming van een dimethyl-gesubstitueerd amide.
Dimethylamine en fosgeen reageren om tetramethylureum te produceren. Reactie met ureum leidt tot het verwachte N,N-dimethylureum.
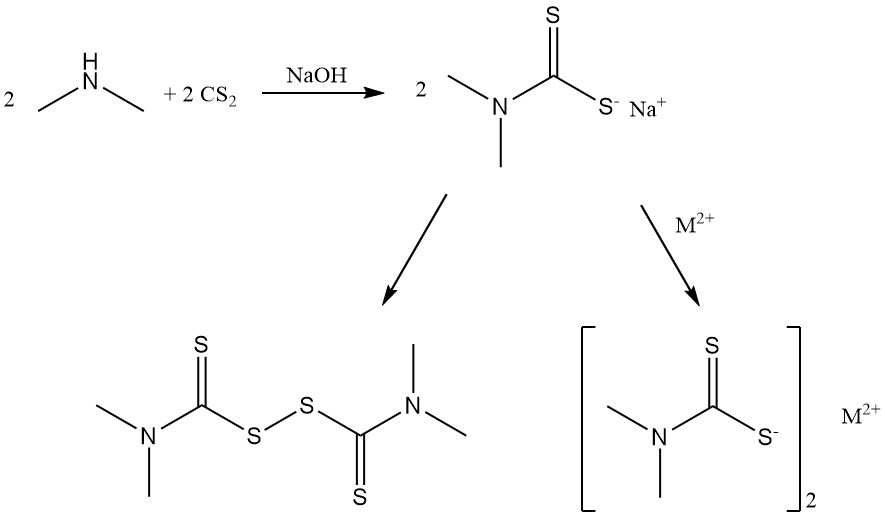
Reactie van dimethylamine met koolstofdisulfide produceert dimethyldithiocarbamaatzouten en bis(dimethyldithiocarbamoyl)disulfide die worden gebruikt als rubberversnellers.
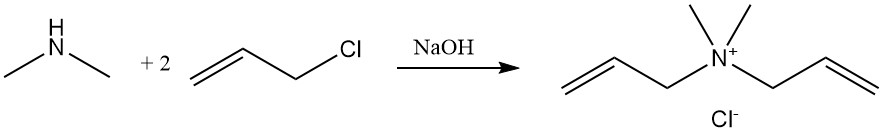
De reactie van dimethylamine met allylchloride produceert diallyldimethylammoniumchloride, een monomeer dat wordt gepolymeriseerd en gebruikt als vlokmiddel in waterzuiveringstoepassingen.
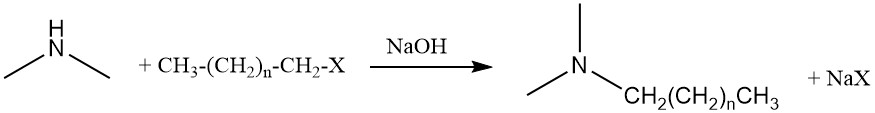
Dimethylamine kan ook een verdere amineringsreactie ondergaan met vetalcoholen of vethalogeniden om alkyldimethylamines te produceren, wat voorlopers zijn van amineoxide-oppervlakteactieve stoffen.
Zowel salpeterigzuur als nitrosylchloride zetten dimethylamine om in de overeenkomstige nitrosamine.
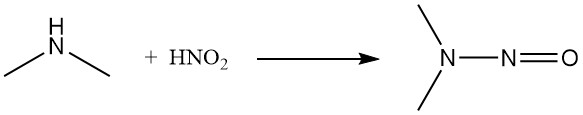
Ethyleenoxide reageert met dimethylamine tot dimethylethanolamine.

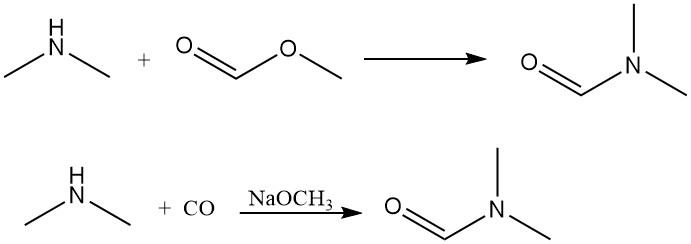
Dimethylamine reageert met methylformiaat om dimethylformamide te genereren, een dipolair aprotisch oplosmiddel. Deze reactie kan ook efficiënt worden bereikt via directe toevoeging van koolmonoxide met een base als katalysator.
Dimethylamine reageert met koolstofdioxide om dimethylaminecarbamaten te vormen onder watervrije omstandigheden en dimethylaminecarbonaten in aanwezigheid van water.
Dimethylamine is corrosief voor aluminium, koper, koperlegeringen, gegalvaniseerd metaal, magnesium, zink en zinklegeringen. Watervrije dimethylamine en de waterige oplossingen ervan kunnen worden verwerkt door materialen te gebruiken die zijn gemaakt van staal.
3. Productie van dimethylamine
Commercieel wordt dimethylamine geproduceerd door de aminering van methanol met ammoniak. Dit proces vindt plaats in de dampfase (300–500 °C en 790–3550 kPa) over reactoren met een vast bed, wat een mengsel van mono-, di- en trimethylamine oplevert.

Methode 1: zuurgekatalyseerde methanolaminering (Leonard-proces)
Deze traditionele methode gebruikt een vaste zuurkatalysator, meestal amorfe silica-alumina, om de hogetemperatuurconversie van methanol te bevorderen. De reactie bereikt een evenwicht, waarbij trimethylaminevorming wordt bevorderd bij lagere ammoniak-tot-methanolverhoudingen. De marktvraag geeft echter prioriteit aan dimethylamine, gevolgd door methylamine en trimethylamine.
Methode 2: vormselectieve zuurgekatalyseerde methanolaminering
Deze methode pakt de selectiviteitsuitdagingen van methode 1 aan door vormselectieve zeolietkatalysatoren te gebruiken (bijv. gemodificeerde mordenieten, RHO en chabaziet). Deze katalysatoren beperken de vorming van omvangrijke trimethylaminemoleculen in hun poriën, wat leidt tot een productmengsel dat verrijkt is met dimethylamine.
Methanolaminering omvat opeenvolgende substitutiereacties, waarbij methanol wordt omgezet in primaire, secundaire en tertiaire aminen. Daarnaast vinden er disproportioneringsreacties plaats, waardoor een evenwicht ontstaat tussen de verschillende methylamineproducten.
Methode 1 werkt doorgaans bij een hoge methanolconversie en is afhankelijk van snelle disproportioneringsreacties. Dit resulteert in een evenwichtsmengsel dat wordt bepaald door de ammoniak-tot-methanolverhouding. Om de gewenste productdistributie te bereiken, worden overtollige niet-gereageerde methylamine en trimethylamine vaak gerecycled, wat veel energie kost.
De komst van vormselectieve zeolietkatalysatoren bood een oplossing om de productselectiviteit te optimaliseren. Vanwege hun beperkte poriegrootte beperken deze katalysatoren de vorming en diffusie van trimethylaminemoleculen, wat de productie van dimethylamine bevordert.
Voorbeelden van commerciële processen zijn onder meer:
- Mitsubishi Rayon-proces: Deze opstelling met twee reactoren gebruikt een niet-selectieve katalysator voor de initiële disproportionering van trimethylamine, gevolgd door een vormselectief zeolietkatalysatorbed voor verdere productaanpassing.
- Mitsui Chemical Process: Dit proces recycleert trimethylamine continu als een azeotropisch mengsel met ammoniak, wat de disproportionering en daaropvolgende omzetting in de gewenste dimethylamine bevordert met behulp van een vormselectieve gesilyleerde mordeniet katalysator.
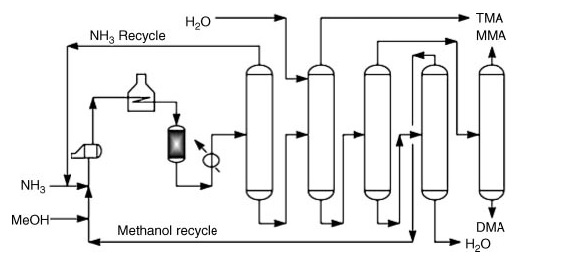
*MMA: methylamine; DMA: dimethylamine en TMA: trimethylamine
Na de reactiestappen omvat het zuivere productherstel een reeks destillatiestappen:
- Ammoniakscheiding en recycling.
- Trimethylamineherstel met water voor verhoogde vluchtigheid.
- Scheiding van methylamine en dimethylamine van water en niet-gereageerde methanol.
- Individuele terugwinning van gezuiverde methylamine en dimethylamine.
- Scheiding van niet-gereageerde methanol van water.
4. Toepassingen van Dimethylamine
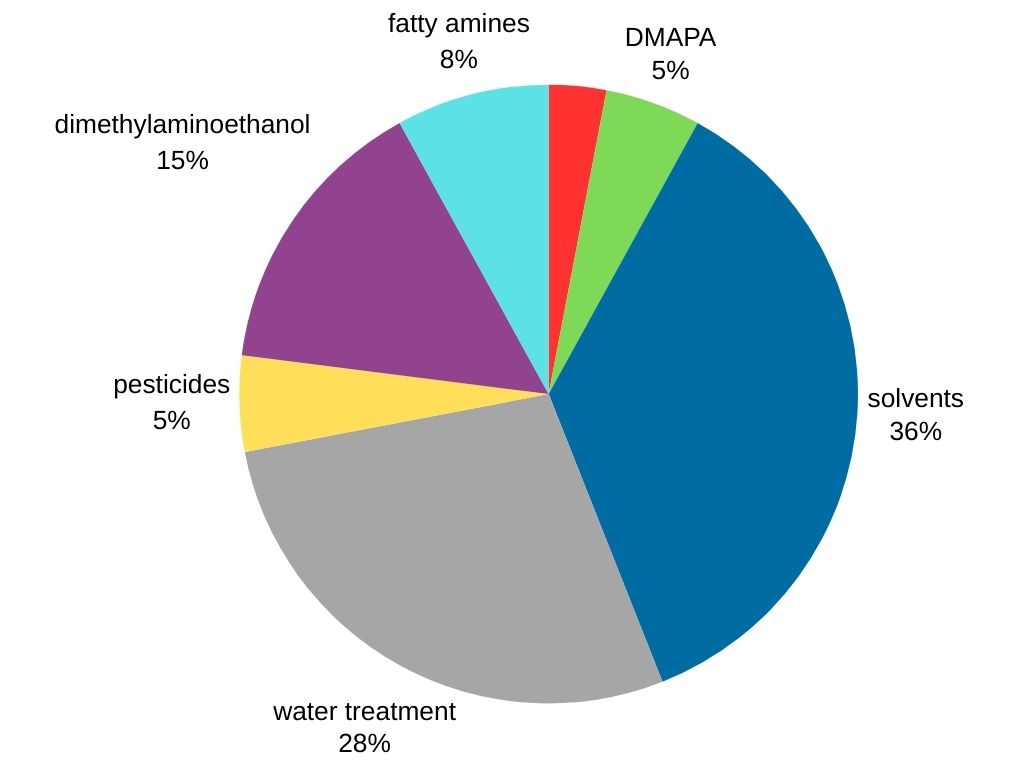
Dimethylamine is de meest gevraagde methylamine op de wereldmarkt. Het wordt gebruikt in verschillende industrieën, waaronder:
- Oplosmiddelproductie: Dimethylamine dient als een cruciale voorloper voor de synthese van populaire oplosmiddelen zoals dimethylformamide en dimethylacetamide.
- Waterbehandeling
- Oppervlakteactieve stoffen: Dimethylamine wordt gebruikt bij de productie van 3-dimethylaminopropylamine (DMAPA), een oppervlakteactieve tussenstof.
- Rubberverwerking: Dimethylamine reageert met koolstofdisulfide om dimethyldithiocarbamaat te produceren, een cruciaal onderdeel bij rubbervulkanisatie, dat de rubbereigenschappen versterkt en verbetert.
- Landbouwchemicaliën (pesticiden)
- Andere chemische producten (dimethylaminoethanol en vetaminen).
5. Toxicologie van dimethylamine
Dimethylamine is een ontvlambare vloeistof of gas dat een aanzienlijk brandgevaar oplevert.
Acute blootstellingseffecten
- Huid- en oogirriterende en bijtende stoffen: Contact kan ernstige brandwonden en irritatie veroorzaken.
- Inademing irriterend: Ademhaling irriteert de neus, keel en longen. Hoge concentraties kunnen vochtophoping in de longen veroorzaken (longoedeem), een medisch noodgeval.
Effecten van chronische blootstelling
- Kan de lever beschadigen bij herhaalde blootstelling.
- Potentieel reproductiegevaar (effecten op mannelijke testikels).
- Kan de longen irriteren, wat leidt tot bronchitis met hoesten, slijm en kortademigheid.
Dimethylamine is volgens de huidige gegevens niet geclassificeerd als kankerverwekkend.
Blootstellingslimieten op de werkplek
- OSHA PEL (toegestane blootstellingslimiet): 10 ppm gemiddeld over een werkdag van 8 uur.
- NIOSH REL (aanbevolen blootstellingslimiet): 10 ppm gemiddeld over een werkdag van 10 uur.
- ACGIH TLV (drempelwaarde): 5 ppm gemiddeld over een werkdag van 8 uur, 15 ppm kortetermijnblootstellingslimiet (STEL).
Voorzorgsmaatregel Maatregelen
- Technische maatregelen: Geef prioriteit aan het insluiten van operaties en het gebruik van lokale afzuigventilatie om blootstelling aan de lucht te minimaliseren.
- Werkpraktijken: Handhaaf goede hygiënepraktijken, vermijd huid- en oogcontact en eet, drink of rook niet in besmette gebieden.
- Persoonlijke beschermingsmiddelen: Wanneer technische maatregelen onvoldoende zijn, draag dan geschikte chemisch bestendige handschoenen, kleding, veiligheidsbrillen of -brillen en ademhalingsmaskers volgens de vastgestelde protocollen.
Opslag en Hanteren
- Bewaren in goed afgesloten containers op een koele, goed geventileerde plaats, uit de buurt van warmtebronnen en onverenigbare chemicaliën (bijv. oxidatiemiddelen, sterke zuren en kwik).
- Aard en verbind metalen containers tijdens overdrachtsoperaties.
- Gebruik vonkvrije gereedschappen en apparatuur, met name bij het hanteren van containers.
Referenties
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/0737.pdf
