Allylchloride: eigenschappen, productie, reacties en toepassingen

Wat is Allylchloride?
Allylchloride, ook bekend als 3-chloorpropeen, is een organische verbinding met de chemische formule C3H5Cl. Het is een kleurloze tot lichtgele vloeistof die van belang is in de organische chemie vanwege zijn reactiviteit en industriële toepassingen.
Het werd voor het eerst geproduceerd in 1857 door Auguste Cahours en August Wilhelm Hofmann door fosforchloride te laten reageren met allylalcohol. De naam “allyl” is afgeleid van het Latijnse woord “allium”, wat “knoflook” betekent. Allylchloride heeft een karakteristieke knoflookgeur die zelfs in kleine hoeveelheden kan worden gedetecteerd.
Eind jaren 30 ontwikkelden IG Farbenindustrie en Shell Development Company een proces voor de productie van allylchloride op grote schaal door propeen bij hoge temperaturen te chloreren. Dit proces zorgde voor hoge opbrengsten van allylchloride en werd snel overgenomen door andere bedrijven, waaronder Dow, Solvay en Asahi-Kashima.
Allylchloride wordt gebruikt in verschillende toepassingen, waaronder de productie van epichloorhydrine, glycerine en pesticiden. Het wordt ook gebruikt als monomeer bij de productie van kunststoffen en harsen.
Inhoudsopgave
1. Fysieke eigenschappen van allylchloride
Allylchloride is een kleurloze, mobiele vloeistof met een doordringende, scherpe geur. Het heeft een moleculair gewicht van 76,53 en een smeltpunt van -134 graden Celsius. Het kookpunt bij 101,3 kPa is 44,4 graden Celsius. De brekingsindex bij 25 graden Celsius is 1,413.
De onderstaande tabel toont de temperatuurafhankelijkheid van de fysieke eigenschappen van allylchloride.
| Temperatuur (°C) | Dichtheid (g/cm³) | Soortelijke warmtecapaciteit (kJ kg⁻¹ K⁻¹) | Viscositeit (mPa s) | Oppervlaktespanning (mN/m) |
|---|---|---|---|---|
| 10 | 0,950 | 1,633 | 368 | 28,2 |
| 15 | 0,944 | 1,666 | 347 | 27,4 |
| 20 | 0,938 | 1,700 | 336 | 26,7 |
| 25 | 0,931 | 1,733 | 315 | 25,9 |
| 30 | 0,925 | 1,771 | 307 | 25,2 |
| 40 | 0,911 | 1,816 | 282 | 24,4 |
| 50 | 0,898 | 1,868 | 257 | 23,7 |
De dampspanning van allylchloride kan worden berekend met de volgende vergelijking:
log(p) = 19,1403 – 2098 / T – 4,2114×log(T)
waarbij p de dampspanning in kPa is en T de temperatuur in Kelvin.
Allylchloride is mengbaar met de meeste oplosmiddelen die algemeen worden gebruikt, zoals octaan, tolueen en aceton. De oplosbaarheid van allylchloride in water bij 20 graden Celsius is 0,36% en de oplosbaarheid van water in allylchloride is 0,08%.
De azeotrope gegevens voor allylchloride worden weergegeven in Tabel 2.
| Component | kookpunt bij 101,3 kPa, °C | Allylchloride, massafractie, % |
|---|---|---|
| Water | 43 | 97,8 |
| Methanol | 40 | 90 |
| Ethanol | 44 | 95 |
| 2-Propanol | 45 | 98 |
| Mierenzuur | 45 | 92,5 |
2. Chemische reacties van allylchloride
Allylchloride is een zeer reactieve verbinding die een verscheidenheid aan additie-, polymerisatie- en substitutiereacties ondergaat. Het chlooratoom in allylchloride kan ook gemakkelijk worden vervangen door andere groepen. Dit maakt allylchloride een veelzijdig startmateriaal voor de synthese van een breed scala aan verbindingen.
2.1. Additiereacties
Allylchloride kan worden toegevoegd aan een verscheidenheid aan verbindingen, waaronder zuurstof, halogenen, waterstofhalogeniden, silanen, boranen, carboranen en fosfortrichloride. Deze reacties kunnen worden gebruikt om een verscheidenheid aan allylderivaten te bereiden.
Wanneer allylchloride bijvoorbeeld reageert met zuurstof in de vloeibare fase bij ca. 120 °C en in aanwezigheid van metaalacetaten of waterstofperoxide, levert het glycerolmonochloorhydrine op.
Wanneer allylchloride reageert met halogenen, levert het de overeenkomstige trihalogeenverbindingen op. De reactie met hypochloorzuur, die 2,3- en 1,3-glyceroldichloorhydrinen oplevert (die vervolgens met alkali worden gedehydrochloreerd om epichloorhydrine te geven), is van groot industrieel belang.
Allylchloride reageert met waterstofhalogeniden om 1,2-dihalogeenverbindingen te vormen. In aanwezigheid van peroxiden levert de reactie met waterstofbromide 1-broom-3-chloorpropaan op (Kharasch-effect), maar in een sterk geconcentreerde waterstofperoxide-oplossing wordt 1,2-dibroom-3-chloorpropaan gevormd.
Additiereacties van silanen, boranen, carboranen en fosfortrichloride, evenals cycloaddities van allylkationen met alkenen, zijn ook bekend. Allylchloride polymeriseert met zwaveldioxide om polysulfonen te vormen.
2.2. Polymerisatie
Allylchloride kan polymeriseren om poly(allylchloride) te vormen, een harde, kleurloze hars. Deze hars wordt gebruikt in verschillende toepassingen, waaronder verf, lijm en kit.
2.3. Substitutiereacties
Het chlooratoom in allylchloride kan eenvoudig worden vervangen door andere groepen, zoals jodide, cyanide, isothiocyanaat, sulfide, polysulfiden en alkylthiolen. Deze reacties kunnen worden gebruikt om verschillende allylderivaten met verschillende eigenschappen te bereiden.
Wanneer allylchloride bijvoorbeeld reageert met natriumsulfiet, ontstaat natriumallylsulfonaat. Natriumallylsulfonaat is een veelzijdige verbinding die wordt gebruikt in verschillende toepassingen, waaronder cosmetica, farmaceutica en voedseladditieven.
Naast deze veelvoorkomende reacties kan allylchloride ook verschillende andere reacties ondergaan, zoals carbonylering, de vorming van organische polycarbonaten en de vorming van allylethers.
Allylchloride is een gevaarlijke verbinding en moet met zorg worden behandeld. Het is een ontvlambare vloeistof en kan huid- en oogirriterend zijn. Het is ook een vermoedelijke kankerverwekkende stof. Als u met allylchloride werkt, is het belangrijk om beschermende kleding te dragen, zoals handschoenen, een veiligheidsbril en een ademhalingstoestel.
3. Productie van allylchloride
3.1. Productie van allylchloride door propeenchloreringsproces
De uitgebreide productie van allylchloride vindt plaats door het hogetemperatuur (300 – 600 °C) chloreringsproces van propeen:
CH2=CH–CH3 + Cl2 → CH2=CH–CH2Cl + HCl (ΔH298 = -113 kJ/mol)
Tijdens deze verhoogde temperaturen verloopt het chloreringsproces via een vrije-radicalenketenmechanisme. Dit mechanisme vervangt voornamelijk het waterstofatoom op de allylpositie door chloor, waardoor allylchloride ontstaat.
3.1.1. Secundaire reacties en bijproducten
Bij temperaturen onder de 200 °C omvat de reactie van propeen met chloor voornamelijk de additie aan de dubbele binding, wat resulteert in de vorming van 1,2-dichloorpropaan. Als de temperatuur boven de 300 °C komt, vindt de vorming van allylchloride plaats, waardoor 1,2-dichloorpropaan als bijproduct ontstaat. Er worden ook in kleine hoeveelheden extra chloreringsproducten gevormd:
- CH3–CH=CH2 + Cl2 → CH3–CHCl–CH2Cl (ΔH298 = -184 kJ/mol)
- ClCH2–CH=CH2 + Cl2 → CH2Cl–CH=CHCl + HCl (ΔH298 = -101 kJ/mol)
- CH3–CH=CH2 + Cl2 → CH3–C(Cl)=CH2 + HCl(ΔH298 = -121 kJ/mol)
- CH3–CH=CH2 + Cl2 → CH3–CH=CHCl + HCl
3.1.2. Kritische procesparameters
Bij de chlorering van propeen tot allylchloride op industriële schaal zijn de temperatuur en de propeen-tot-chloorverhouding de meest invloedrijke factoren. Druk en verblijftijd hebben minimale invloed op de opbrengst van allylchloride.
Om de productie van 1,2-dichloorpropaan onder 200 °C te voorkomen, moet de mengtemperatuur van propeen en chloor boven 250 – 300 °C worden gehouden. De hoogste opbrengsten van allylchloride worden verkregen in industriële reactoren die werken bij een piektemperatuur van 500 – 510 °C.
Als de temperatuur dit bereik overschrijdt, ontstaat spontane pyrolyse, wat leidt tot roet en hoogkokende teer. Onder experimentele omstandigheden bij ongeveer 600 °C vormt zich benzeen, wat leidt tot een vermindering van de opbrengst aan allylchloride.
3.1.3. Propeen-chloorverhouding
Een toename van de propeenovermaat resulteert in een verminderde vorming van bijproducten. Het verhoogt echter de kosten voor propeenverwerking. Bijgevolg worden optimale reactieomstandigheden gevormd door economische factoren, waaronder de vereiste voor dichloridebijproducten voor gebruik als nematiciden. Deze bijproducten kunnen ook dienen als uitgangsmaterialen voor de synthese van oplosmiddelen van het type C1 of C2.
3.1.4. Reactordruk en verblijftijd
De druk van de reactor heeft minimale invloed op de productopbrengst en -distributie. Deze wordt uitsluitend bepaald door de drukdaling binnen het propeencirculatiesysteem. Op dezelfde manier heeft de verblijftijd een beperkte invloed op de opbrengst aan allylchloride.
Chloor reageert volledig binnen 1 – 3 seconden bij hoge temperaturen van 300 tot 600 °C en een te lange verblijftijd leidt tot thermische ontleding van allylchloride.
3.1.5. Reactorontwerp en materiaalselectie
Reactoren op industriële schaal werken voornamelijk adiabatisch, hoewel optimale opbrengsten kunnen worden gerealiseerd met isotherme werking. Vanwege de snelle en exotherme aard van de reactie is het warmteverlies door de reactorwanden onbeduidend laag.
Het meest eenvoudige en traditionele type reactor is de buisreactor, vaak uitgerust met gasdispersie- en roetverwijderingsfuncties. Er worden talloze andere reactorconfiguraties herkend, die er allemaal naar streven om snelle en grondige menging van reactanten te vergemakkelijken om de vorming van 1,3-dichloorpropeen te beperken.
Bij zeer turbulente stromingsomstandigheden worden propeen en chloor in de reactiezone geïntroduceerd met snelheden tot 300 m/s. Het belang van nauwkeurige mengomstandigheden wordt onderstreept door een cycloonreactor, waarbij vergelijkbare opbrengsten worden bereikt bij een molaire verhouding van 3:1 in vergelijking met een verhouding van 5:1 met alternatieve ontwerpen. Verschillende reactoren hebben koelmantels.
Door een cascade van reactoren met verdeeld chloor te gebruiken, kunnen chlooromzettingspercentages tot 86% worden bereikt. Een dergelijke opstelling maakt hogere voorverwarmingstemperaturen mogelijk vanwege hogere propeen:chloorverhoudingen in de oorspronkelijke reactor.
3.1.6. Voorbereiding van de grondstof
De zuiverheid van propeen en chloor is erg belangrijk. Onzuiverheden in propeen veroorzaken de vorming van bijproducten en chloorverlies. Met name propaan stimuleert de ontwikkeling van chloorderivaten (1-chloorpropaan, 2-chloorpropaan) die moeilijk te scheiden zijn.
Voor de grondstof wordt vaak propeen met een zuiverheid van polymeerkwaliteit, rond de 99,5%, gebruikt. Om voldoende zuiverheid te garanderen, wordt chloor opnieuw verdampt. Dit introduceert echter sporen van inerte gassen, wat leidt tot propeenverlies bij ontluchting. Zowel propeen als chloor moeten zo watervrij mogelijk zijn.
3.1.7. Procesoverzicht
Een vergelijkbaar proces als dat van Shell wordt weergegeven in Figuur 1.
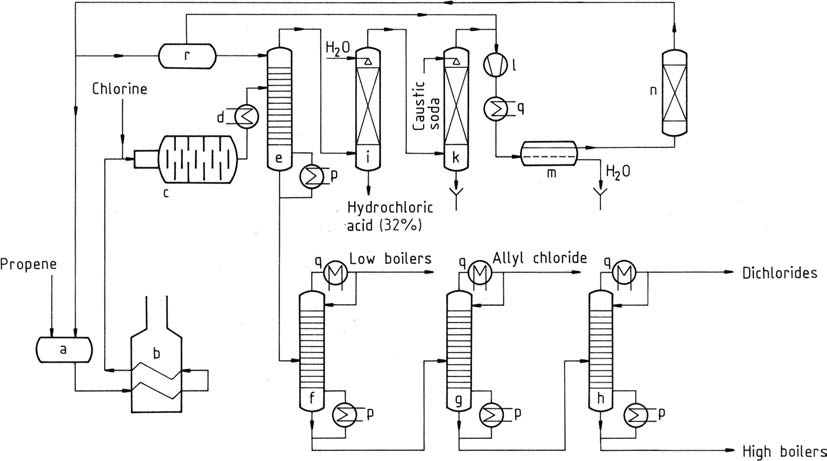
a) Opslagvat voor vloeibaar propeen; b) Verdamper en oververhitter voor propeen; c) Reactor; d) Koeler; e) Prefractionator; f) Light-ends-kolom; g) Allylchloride-zuiveringskolom; h) Dichloorpropeenkolom; i) Waterstofchloride-absorber; k) Gaswasser; l) Compressor; m) Decanter voor het verwijderen van water; n) Propeendroger; p) Verdamper; q) Condensor; r) Koude propeenopslagvat
Vloeibaar propeen wordt verdampt, gevolgd door voorverwarmen tot temperaturen van 350 – 400 °C (b). Dit mengsel wordt samen met gasvormig chloor in de reactor (c) gebracht via een mengstraal.
De volledige chloorreactie verhoogt de temperatuur tot 500 – 510 °C (onder optimale omstandigheden). Zelfs onder de beste omstandigheden vindt er minimale koolstofvorming plaats, wat chlorering katalyseert. Er vormt zich een beschermende film van glasachtige koolstof op de reactorwanden.
Dit materiaal, dat bestaat uit sterk gechloreerde stoffen en teer, vereist periodieke reiniging om de 4 – 8 weken. Vaak worden parallelle reactorketens gebruikt om de gedeeltelijke productie tijdens de reiniging te behouden, of kan afwisselende werking van de twee ketens worden nagestreefd.
De gasstroom die uit de chloreringsreactor komt, ondergaat voorkoeling (d) en wordt naar een prefractionator (e) geleid. De overheadtemperatuur van deze prefractionator, die op ongeveer -40 °C wordt gehouden, wordt beheerd door vloeibare propeentoevoer. Dit scheidt gechloreerde koolwaterstoffen, waarbij het onderste product vrij is van propeen en waterstofchloride.
Het gasvormige mengsel bovenin wordt gescheiden door waterabsorptie (i), wat resulteert in commercieel waterig waterstofchloride en propeen. Propeen wordt vervolgens gewassen met natronloog in een scrubber (k) om sporen waterstofchloride te verwijderen.
Na compressie tot 1,2 MPa (12 bar) wordt propeen gecondenseerd in een condensor (l, q). Vloeibaar propeen wordt gedroogd door adsorptie (n) en water wordt verwijderd (m) en vervolgens teruggebracht naar de opslag (a).
Het onderste product van de prefractionator bevat 80% allylchloride, 3% 2-chloor-1-propeen en andere laagkokende componenten, samen met 16% dichloriden (voornamelijk 1,2-dichloorpropaan en cis- en trans-1,3-dichloor-1-propeen) en 1% 1,2,3-trichloorpropaan en andere hoogkokende fracties. Deze fracties kunnen verder worden gescheiden door destillatie (f, g, h).
3.1.8. Materiaalkeuze voor constructie
De keuze van materialen voor allylchloridesynthese (propeencirculatie) is afhankelijk van processpecificaties, temperatuur en druk. Standaard koolstofstaal kan worden gebruikt waar productstromen een laag watergehalte behouden.
Als chloor niet wordt voorverwarmd, kan koolstofstaal ook worden gebruikt in het reactorgebied. Toch vereist de hogetemperatuurchloorbestendigheid in het reactorgebied materialen zoals chroom-nikkelstaal, nikkel en koper-nikkellegeringen.
Grafiet- en PTFE-coatings zijn ideaal voor de absorptie van waterstofchloride, terwijl gerubberd staal geschikt is voor de natronloogwasser. Koolstofstaal is voldoende voor de gehele gechloreerde koolwaterstoffractioneringsinstallatie, hoewel omgevingen met aanzienlijke watervolumes dure materialen zoals nikkel en koper-nikkel vereisen. Droog allylchloride kan in stalen vaten worden opgeslagen zonder corrosieproblemen.
3.2. Andere productieprocessen
Er zijn alternatieve processen voorgesteld voor de synthese van allylchloride, maar geen van deze methoden is op commerciële schaal geïmplementeerd.
3.2.1. Katalytische chlorering van propeen
De chlorering van propeen in deze methode maakt gebruik van katalysatoren die tellurium bevatten, wat resulteert in allylchlorideopbrengsten tot 82%. Het primaire bijproduct is 17% 2-chloorpropaan (isopropylchloride). Alle niet-gereageerde propeen en het waterstofchloride dat tijdens de reactie ontstaat, kunnen in een volgende stap, waarbij oxychlorering plaatsvindt, worden omgezet in allylchloride.
3.2.2. Dehydrochlorering van 1,2-dichloorpropaan
Het dehydrochloreringsproces van 1,2-dichloorpropaan leidt tot een bescheiden opbrengst van slechts 55% allylchloride, vergezeld van een aanzienlijke hoeveelheid monochloorpropenen. Ondanks dat er wordt begonnen met overvloedige hoeveelheden dichloorpropaan, die worden geproduceerd tijdens de productie van propeenoxide, heeft dit proces geen commerciële toepassingen.
3.2.3. Oxychlorering
Oxychlorering werd ontwikkeld als een aanpak om allylchloride te produceren door gebruik te maken van gemakkelijk verkrijgbaar waterstofchloride in plaats van chloor als primaire grondstof. Er zijn verschillende katalysatorsystemen voorgesteld, waaronder palladium, vanadium, tellurium, koper, lithium, mangaan, evenals hun respectievelijke chloriden, oxiden en combinaties daarvan.
Hoewel veel van deze oxychloreringsprocessen beginnen met propeen, beginnen er een paar met propaan.
Eén proces, geëvalueerd in een pilot-installatie door Hoechst, omvat de reactie van propeen, waterstofchloride, zuurstof en 2-chloorpropaan (dat kan worden geproduceerd in een secundaire reactor of extern kan worden geïntroduceerd) in een primaire wervelbedreactor die werkt bij temperaturen van 200 – 260 °C en 0,1 MPa (1 bar) overdruk (ΔH = -218 kJ/mol).
Het katalysatormengsel omvat tellurium, vanadiumpentoxide, fosforzuur en een stikstofverbinding als promotor. Een deel van de katalysatorstroom wordt behandeld met lucht en salpeterzuur in een zijstroom om cokesvorming te elimineren en een consistente reactiviteit te behouden.
In een aparte reactor wordt 2-chloorpropaan geproduceerd uit propeen, waterstofchloride en een ferrichloride-oplossing. Het niet-gereageerde propeen, 2-chloorpropaan en waterstofchloride worden gescheiden en gerecycled.
De opbrengst van allylchloride varieert van 88% tot 94% op basis van de propeeninput. De zuiverheid van propeen is in dit geval niet erg kritisch.
Bepaalde oxychloreringsbenaderingen hebben inherente nadelen. Zo nemen de katalysatoractiviteiten snel af vanwege de vluchtigheid van de gebruikte metaalzouten, waardoor grote reactorvolumes nodig zijn vanwege de lage conversie per doorgang.
Ook het extraheren van sterk verdund allylchloride uit het reactiemengsel zonder overmatig propeenverlies door oxidatie levert uitdagingen op. Een oplossing hiervoor is het gebruik van mangaandioxide als zowel katalysator als zuurstofdrager. De belangrijkste reacties die in de primaire reactor plaatsvinden, zijn als volgt:
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
C3H6 + Cl2 → C3H5Cl + HCl
De katalysator wordt vervolgens opnieuw geoxideerd en geactiveerd met zuurstof:
MnCl2 + O2 → MnO2 + Cl2
Dit proces bereikt allylchloride-opbrengsten variërend van 71% tot 81% op basis van propeenverbruik.
4. Toepassingen van Allylchloride
Allylchloride is een belangrijk tussenproduct in de petrochemische industrie. Het wordt voornamelijk gebruikt om epichlorohydrine te produceren, wat wordt gebruikt om epoxyharsen te maken. Allylchloride is ook een uitgangsmateriaal voor de synthese van verschillende andere chemicaliën, zoals glycerol, esters, allylethers en allylamines.
Andere verbindingen die kunnen worden gemaakt van allylchloride zijn allylisothiocyanaat (synthetische mosterdolie), allylsulfonaat, allylsilane en cyclopropaan.
Hier is een meer gedetailleerde uitsplitsing van het gebruik van allylchloride:
- Epichlorohydrine: Allylchloride wordt gebruikt om epichlorohydrine te produceren, wat een veelzijdige verbinding is met een breed scala aan toepassingen. Epichlorohydrine wordt gebruikt om epoxyharsen te maken, die worden gebruikt in verschillende producten, waaronder lijmen, coatings en composieten. Epichlorohydrine wordt ook gebruikt om glycerol te maken, een zoete, kleurloze vloeistof die wordt gebruikt in verschillende producten, waaronder voedsel, cosmetica en farmaceutica.
- Verestering: Allylchloride wordt gebruikt bij de verestering van ftaalzuur, fosforzuur en carbonzuur. Dit proces produceert esters, wat verbindingen zijn met een breed scala aan toepassingen. Esters worden gebruikt in parfums, smaakstoffen en kunststoffen. Ze worden ook gebruikt als oplosmiddelen en als tussenproducten bij de productie van andere chemicaliën.
- Allylethers en allylamines: Allylchloride wordt gebruikt om allylethers en allylamines te produceren. Allylethers zijn verbindingen met een karakteristieke geur die worden gebruikt in parfums en smaakstoffen. Allylamines zijn verbindingen met een breed scala aan toepassingen. Ze worden gebruikt in farmaceutische producten, landbouwchemicaliën en kunststoffen.
- Andere verbindingen: Allylchloride kan ook worden gebruikt om andere verbindingen te produceren, zoals allylisothiocyanaat, allylsulfonaat, allylsilane en cyclopropaan. Allylisothiocyanaat is een verbinding met een sterke geur die wordt gebruikt in gewasbeschermingsmiddelen en farmaceutische preparaten. Allylsulfonaat wordt gebruikt als additief voor galvaniseerbaden en bij de productie van koolstofvezels. Allylsilane wordt gebruikt voor de productie van additieven voor de rubberindustrie. Cyclopropaan is een verdovingsmiddel dat wordt gebruikt bij operaties.
5. Behandeling en milieubescherming van allylchloride
Allylchloride is een zeer reactieve, giftige en ontvlambare stof. Het is daarom in veel landen onderworpen aan strenge regelgeving met betrekking tot de uitstoot ervan in de atmosfeer. Allylchloride moet in gesloten systemen worden behandeld om aan deze regelgeving te voldoen.
Gasvormige mengsels die allylchloride of bijproducten afkomstig van het productieproces bevatten, moeten worden gezuiverd via condensatie, absorptie, adsorptie of verbranding voordat ze worden afgevoerd. Een effectieve techniek voor het overbrengen van allylchloride van de ene container naar de andere is de compensatietechniek.
Verontreiniging van de bodem, het grondwater, waterwegen of afvalwater moet koste wat het kost worden vermeden. Elke mogelijke verontreiniging moet onmiddellijk aan de autoriteiten worden gemeld.
Het afvoeren van allylchloridehoudend afval vormt geen groot gevaar wanneer gespecialiseerde verbrandingsovens worden gebruikt, zoals die voor het afvoeren van oplosmiddelen. De verbrandingsgassen van deze verbrandingsovens moeten worden behandeld in absorbers of scrubbers om het gevormde waterstofchloride te verwijderen.
Vanwege de hoge vluchtigheid en het lage vlampunt moeten fabrieken voor de productie en verwerking van allylchloride voldoen aan strenge brand- en explosieveiligheidsvoorschriften.
Bij de verbranding van gechloreerde koolwaterstoffen komt waterstofchloride vrij, dus brandweerlieden die reageren op branden waarbij allylchloride betrokken is, moeten zijn uitgerust met beschermende pakken en ademhalingsapparatuur. Onvoldoende luchttoevoer tijdens de verbranding kan leiden tot de vorming van koolmonoxide.
Allylchloride is zeer reactief en kan heftig, exotherm en zelfs explosief reageren met andere stoffen. Dit geldt met name voor alkali- en aardalkalimetalen, maar ook voor aluminium en zink en sterke oxidatiemiddelen, zoals geconcentreerd zwavelzuur.
De watervrije haliden (bijv. chloriden) van de hierboven genoemde metalen reageren ook heftig met allylchloride. Er moet zorgvuldig worden nagedacht over de veiligheidsaspecten van deze exotherme reacties in fabrieken die allylchloride produceren of verwerken.
In 1996 classificeerde de Europese Unie allylchloride als “gevaarlijk voor het milieu” en “zeer giftig voor waterorganismen”.
6. Toxicologie en gezondheid op het werk
In laboratoriumonderzoeken met ratten en konijnen gaven de LD50-waarden aan dat de orale consumptie van 460 mg/kg allylchloride dodelijk bleek voor ratten, terwijl de percutane toediening van 3,7 mg/kg leidde tot sterfte bij konijnen. Bovendien resulteerde de inhalatie van allylchloride in een concentratie van 11 mg/l gedurende 2 uur in een dodelijke afloop voor ratten.
Allylchloride is een giftige chemische stof die kan worden opgenomen door inademing, inname en via de huid.
Het is een sterke irriterende stof voor de huid en slijmvliezen en kan symptomen veroorzaken zoals oogirritatie, hoesten, kortademigheid en gevoelloosheid.
In hoge concentraties kan allylchloride longoedeem (vocht in de longen), hartschade, leverschade en nierschade veroorzaken.
Het wordt ook verdacht van het feit dat het een kankerverwekkende en mutagene stof is.
De drempelwaarde (TLV) voor allylchloride is 1 ppm (8 uur tijdgewogen gemiddelde). Dit betekent dat de gemiddelde concentratie allylchloride in de lucht niet hoger mag zijn dan 1 ppm voor een werkdag van 8 uur.
De kortdurende blootstellingslimiet voor allylchloride is 2 ppm. Dit betekent dat de concentratie allylchloride in de lucht niet hoger mag zijn dan 2 ppm gedurende een periode van 15 minuten.
Allylchloride heeft een scherpe geur, maar deze geur is geen betrouwbaar waarschuwingssignaal. De geurwaarnemingsdrempel voor allylchloride is 3 tot 6 ppm, wat aanzienlijk boven de toegestane werkconcentraties ligt.
Er is beperkt onderzoek gedaan naar de effecten van allylchloride op de menselijke gezondheid. Het beschikbare bewijsmateriaal suggereert echter dat het een giftige chemische stof is met het potentieel om verschillende gezondheidsproblemen te veroorzaken, waaronder kanker en reproductieve schade.
Het is belangrijk om op te merken dat de informatie in de tekst slechts een samenvatting is van de bekende toxiciteit van allylchloride. De werkelijke effecten van blootstelling aan allylchloride kunnen variëren, afhankelijk van het blootstellingsniveau van het individu, de duur van de blootstelling en andere factoren.
Referenties
- Allylverbindingen; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_425
- https://www.solvay.com/sites/g/files/srpend221/files/2021-01/PSS-Allyl-Chloride-Epichlorohydrin.pdf
