Zoutzuur: Eigenschappen, Productie en Toepassingen
Zoutzuur is een oplossing van sterk anorganisch zuur met de chemische formule HCl. Het is een kleurloze vloeistof met een scherpe geur die zeer corrosief is voor de huid, ogen en metalen.
Geschiedenis van de ontdekking
In de 15e eeuw paste een Duitse alchemist genaamd VALENTIN hitte toe op een substantie genaamd groene vitriool (FeSO4·7 H2O) samen met keukenzout. Als resultaat verkreeg hij een substantie die bekend staat als spiritus van zout.
In de 17e eeuw synthetiseerde GLAUBER zoutzuur door keukenzout te combineren met zwavelzuur. Het was in 1790 toen DAVY de samenstelling van waterstofchloride vaststelde door de synthese van waterstof en chloor.
In hetzelfde jaar ontdekte LEBLANC een proces, naar hem vernoemd, voor de productie van soda. Dit proces omvatte het laten reageren van keukenzout met zwavelzuur, wat resulteerde in de vrijgave van waterstofchloride. Aanvankelijk werd het beschouwd als een ongewenst bijproduct, maar het kwam in aanzienlijke hoeveelheden in de atmosfeer terecht.
In 1863 dwong de Alkali Act Engelse frisdrankproducenten er echter toe om het waterstofchloride in water op te lossen, wat leidde tot het wijdverbreide industriële gebruik van het geproduceerde zuur. Overtollig waterstofchloride dat niet als zoutzuur kon worden gebruikt, werd geoxideerd tot chloor.
De industriële synthese van waterstofchloride ontstond samen met de ontwikkeling van het chloor-alkali-elektrolytische proces in het begin van de 20e eeuw. Deze methode, naast de methode die gebaseerd was op de reactie tussen chloriden en zwavelzuur of natriumwaterstofsulfaat, leverde een zuiverder product op.
Deze processen nemen geleidelijk aan in belang af vanwege de aanzienlijke hoeveelheden waterstofchloride die als bijproducten worden gegenereerd in chloreringsprocessen zoals de productie van vinylchloride uit ethyleen. Bovendien kan zoutzuur worden teruggewonnen uit gassen die vrijkomen bij de verbranding van chloorhoudend afval, wat aansluit bij de groeiende aandacht voor milieubescherming.
Inhoudsopgave
1. Fysieke eigenschappen van zoutzuur
Waterstofchloride (HCl) bestaat onder standaardomstandigheden als een transparant gas dat wordt gekenmerkt door zijn sterke geur en zeer corrosieve impact op de slijmvliezen van het ademhalingssysteem.
Enkele fysieke eigenschappen van waterstofchloride worden in de volgende tabel gepresenteerd:
| Eigenschap | Waarde |
|---|---|
| Molaire massa | 36,461 g/mol |
| Smeltpunt | -114,22 °C |
| Kookpunt | -85,05 °C |
| Dampdichtheid | 1,639 g/L |
| Vloeistofdichtheid | 1,18 g/mL |
| Kritisch Temperatuur | 51 °C |
| Kritische druk | 81,6 bar |
2. Chemische eigenschappen van zoutzuur
Waterstofchloride vertoont thermische stabiliteit tot ongeveer 1500 °C, waarna het significante dissociatie ondergaat. In zijn volledig droge vorm vertoont waterstofchloride beperkte reactiviteit, met verwaarloosbare aantasting van zacht staal.
Bovendien vereisen reacties met watervrij waterstofchloride doorgaans de aanwezigheid van katalysatoren. Omgekeerd, wanneer waterstofchloride wordt opgelost in een polair oplosmiddel, zoals water, transformeert het in een krachtig zuur en wordt het bijgevolg een zeer reactief reagens.
De oplosbaarheid van waterstofchloride in water is substantieel, vergezeld van de afgifte van een significante hoeveelheid warmte. Dit resulteert in de vorming van zoutzuur, dat een formidabele en buitengewoon agressieve aard bezit.
Het vertoont het vermogen om de meeste commercieel verkrijgbare metalen en legeringen in verschillende mate te corroderen. Bijgevolg vereisen metalen bescherming door het gebruik van geschikte niet-metalen voeringen of niet-metalen bouwmaterialen.
Onder nauwkeurig gedefinieerde omstandigheden kunnen tantaal of zeer resistente nikkellegeringen zoals Hastelloy B worden gebruikt. Minder edele metalen lossen echter op, wat leidt tot de vrijgave van waterstofgas.
3. Productie van zoutzuur (HCl)
De aanwezigheid van vrij waterstofchloride in de natuur is beperkt en komt alleen voor in lage concentraties. Het is in de stratosfeer aangetroffen in hoeveelheden van ongeveer 10-11 volumeprocent.
Aan de andere kant hebben anorganische chloriden een brede verspreiding, waarbij chloor het elfde meest voorkomende chemische element is. Alkalimetaal- en aardalkalichloriden, met name steenzout, dienen als primaire grondstoffen voor verschillende methoden voor de productie van waterstofchloride of zoutzuur.
Deze methoden omvatten processen waarbij tussenproducten zoals chloor of gechloreerde organische verbindingen betrokken zijn.
In natuurlijke gevallen komt waterstofchloride vrij tijdens vulkaanuitbarstingen of andere vrijlatingen van ondergrondse gassen. De hoeveelheid geproduceerd waterstofchloride kan vergelijkbaar zijn met die van zwaveldioxide.
Zoutzuur is van nature aanwezig in het maagsap van zoogdieren, met een concentratie van ongeveer 0,1 mol/L in de menselijke maag.
3.1. Methoden voor de bereiding van zoutzuur (HCl)
Waterstofchloride (HCl) wordt bereid door verschillende reacties:
1. Synthese uit elementen:
De combinatie van waterstofgas en chloorgas leidt tot de vorming van waterstofchloridegas:
H2 + Cl2 → 2 HCl
2. Reactie van metaalchloriden met zwavelzuur:
Metaalchloriden, met name natriumchloride, kunnen reageren met zwavelzuur of waterstofsulfaat om waterstofchloride te produceren:
Metaalchloride + H2SO4 → HCl + Metaalsulfaat
3. Bijproducten van chlorering:
Tijdens de productie van verschillende gechloreerde organische verbindingen zoals dichloormethaan, trichloorethyleen, perchloorethyleen of vinylchloride, wordt waterstofchloride gevormd als bijproduct via een reeks reacties:
C2H4 + Cl2 → C2H4Cl2
C2H4Cl2 → C2H3Cl + HCl
4. Thermische ontleding van gehydrateerde zware-metaalchloriden:
Waterstofchloride kan worden verkregen uit de thermische ontleding van gehydrateerde zware-metaalchloriden die aanwezig zijn in gebruikte beitsvloeistof die wordt gebruikt voor metaalbehandeling.
5. Verbranding van gechloreerd organisch afval:
Wanneer gechloreerd organisch afval wordt verbrand, ontstaat waterstofchloride als resultaat:
C4H6Cl2 + 5 O2 → 4 CO2 + 2 H2O + 2 HCl
De primaire bron van waterstofchloride is tegenwoordig het bijproduct dat wordt verkregen uit chloreringsprocessen. Het vereiste zuiveringsniveau is afhankelijk van de beoogde toepassing. Momenteel neemt de winning van waterstofchloride uit afvalmaterialen toe.
Daarnaast kan waterstofchloride worden gevormd in ongewenste reacties zoals de hydrolyse van Friedel-Crafts-katalysatoren:
AlCl3 + 3 H2O → Al(OH)3 + 3 HCl
3.2. Industriële productie van zoutzuur
3.2.1. Productie van zoutzuur uit waterstof en chloor
De meest eenvoudige methode voor het produceren van waterstofchloride is de directe synthese uit de elementaire componenten, wat resulteert in een zeer zuiver product. Deze reactie is zeer exotherm, met een standaardenthalpie van de reactie (ΔH) van -184 kJ.
Het is belangrijk om op te merken dat mengsels van waterstof en chloor extreem explosief kunnen zijn in een breed scala aan samenstellingen. Licht kan dienen als een initiator voor een explosie. Daarom moeten voorzorgsmaatregelen worden genomen om de vorming van reactieve mengsels van chloor en waterstof in industriële processen te voorkomen.
Bij industriële productie wordt een brander gebruikt, waarbij chloor en waterstof afzonderlijk via concentrische buizen in de verbrandingskamer worden gevoerd. Eenmaal ontstoken, brandt chloor in aanwezigheid van waterstof, waarbij een hete en stille vlam ontstaat bij temperaturen boven de 2000 °C.
Silica heeft zijn effectiviteit bewezen als een geschikt constructiemateriaal voor de brander. Gietijzer of staal, soms watergekoeld, of grafiet zijn ook gebruikt.
Meestal bevindt de brander zich onderaan een cilindrische verbrandingskamer, met de vlam verticaal omhoog gericht. De verbrandingskamer zelf is gemaakt van staal en bekleed met vuurvaste baksteen. Een koelgedeelte, van de juiste grootte en vorm, is verbonden met de verbrandingskamer.
Als de reactanten zeer vochtig of verontreinigd zijn, moeten corrosiebestendige bouwmaterialen zoals silica of grafiet worden gebruikt.
Bestaande productiefaciliteiten zijn voornamelijk gebouwd met koolstofstaal en het geproduceerde waterstofchloride wordt alleen met water gekoeld tot een temperatuur waarbij waterig zoutzuur niet kan condenseren.
De primaire verontreinigingen zijn vocht in waterstof en zuurstof in chloor, hoewel zuurstofverbindingen zoals dichlooroxide of koolstofdioxide ook problemen kunnen opleveren door water te vormen.
De mengverhouding van de grondstoffen wordt aangepast op basis van het beoogde gebruik van het geproduceerde waterstofchloride. Er kan een kleine overmaat aan waterstof of chloor worden gebruikt.
Werken met exact equimolaire mengsels wordt afgeraden omdat de reactie niet volledig kwantitatief is en het moeilijker wordt om explosieve mengsels te voorkomen.
Afwijkingen in de besturing kunnen leiden tot intermitterende verschuivingen tussen overtollige waterstof en overtollige chloor, wat resulteert in het incidenteel verschijnen van explosieve mengsels.
Normaal gesproken levert waterstof in waterstofchloride minder uitdagingen op dan chloor, dus wordt er vaak een lichte overmaat van 1-2% waterstof gebruikt. Afhankelijk van de zuiverheid van de grondstoffen is het mogelijk om waterstofchloride te verkrijgen dat volledig vrij is van chloor, waarbij overtollige waterstof de enige onzuiverheid is.
Deze zeer zuivere waterstofchloride kan worden gebruikt om uitzonderlijk zuiver zoutzuur te produceren of kan worden vloeibaar gemaakt of rechtstreeks aan gebruikers worden geleverd als een droog gas via stalen pijpleidingen.
Het gebruik van staal voor syntheseovens en koelers is een aantrekkelijke optie. Dit maakt het mogelijk om te werken onder verhoogde druk, die wordt bepaald door de druk van chloor en waterstof, evenals de temperatuur en druk in de pijpleiding.
Het is cruciaal om een druk laag genoeg of een temperatuur hoog genoeg te houden om condensatie van waterig zoutzuur te voorkomen. De staalovens die in H€uls worden gebruikt, kunnen bijvoorbeeld elk 30-40 ton waterstofchloride per dag produceren.
Het gegenereerde waterstofchloridegas heeft een druk van maximaal 0,7 MPa en een watergehalte van minder dan 50 ppm (op volumebasis), waardoor het gebruik van stalen buizen voor transport vanaf de fabriek noodzakelijk is.
Chemisch gerelateerde processen omvatten de reactie van chloor met koolstof (in de vorm van cokes) en waterdamp:
C + 2 H2O + 2 Cl2 → 4 HCl + CO2
Een ander verwant proces betreft de reactie van chloor met zwaveldioxide en water:
SO2 + 2 H2O + Cl2 → 2 HCl + H2SO4
3.2.2. Productie van waterstofchloride door reactie van metaalchloriden met zwavelzuur
Het sulfaatproces wordt gekenmerkt door een hoog energieverbruik. Bijgevolg is het belang ervan geleidelijk afgenomen in vergelijking met andere processen, met name organische chlorering, die aanzienlijke hoeveelheden waterstofchloride als bijproduct genereert.
Bovendien is het argument dat sulfaat-zoutzuur een product van hogere zuiverheid oplevert, niet langer geldig. Bijproductzuur kan nu adequaat worden gezuiverd om te voldoen aan de vereisten voor hoge kwaliteitsnormen. Daarom zal hier alleen het belangrijkste sulfaat-zoutzuurproces worden besproken.
De reactie tussen keukenzout en geconcentreerd zwavelzuur vindt plaats bij relatief lage temperaturen (150-300 °C), wat resulteert in de vorming van waterstofchloride en natriumwaterstofsulfaat.
Dit laatste reageert met overtollig natriumchloride bij een minimale temperatuur van 550-600 °C, waarbij neutraal natriumsulfaat ontstaat. Hoewel het technisch haalbaar is om natriumwaterstofsulfaat als uitgangsmateriaal te gebruiken, is het stopgezet vanwege de oneconomisch aard van het proces, veroorzaakt door de hoge temperaturen (600-800 °C) en het energieverbruik.
Momenteel is zwavelzuur het exclusieve uitgangsmateriaal. In het Mannheim-proces wordt natriumsulfaat geproduceerd, terwijl in het Berlijnse zoutzuurproces natriumwaterstofsulfaat wordt gebruikt.
In het Mannheim-proces worden extern gestookte muffelovens gebruikt die zijn bekleed met bakstenen. Deze ovens omvatten een roermechanisme met een schrapende werking om de vorming van klonten in de pasta-achtige massa te voorkomen en om het geproduceerde natriumsulfaat te verwijderen.
Waterstofchloride wordt via de zijkant van de muffel afgevoerd en door een ventilator naar de volgende fase voortgestuwd, waarbij de oven op een licht verlaagde druk wordt gehouden.
Het uitlaatgasmengsel van de oven bevat tot 85% waterstofchloride, samen met lucht, zwavelzuurnevel en fijne zoutdeeltjes. Normaal gesproken ondergaat het gas meerdere zuiveringsstappen, waaronder filtratie door cokes en actieve kool, natte wassing of chemische reacties.
Het Berlijnse zoutzuurproces levert waterstofchloridegas op met een aanzienlijk hogere zuiverheid dan het Mannheim-proces. De reactie tussen keukenzout en zwavelzuur vindt plaats in gesmolten natriumwaterstofsulfaat bij ongeveer 300 °C in gietijzeren retorten.
Als alternatief kan kaliumchloride worden gebruikt, wat resulteert in de productie van waterstofchloride en kaliumwaterstofsulfaat. Dit proces behoudt enige commerciële betekenis vanwege de primaire producten die de gevormde kaliumzouten zijn (d.w.z. KHSO4 en K2S2O7), waarbij waterstofchloride als bijproduct wordt beschouwd.
Gas uit de retorten is geconcentreerder vanwege de verbeterde lekvrije aard van de apparatuur, wat resulteert in lagere niveaus zwavelzuurnevel als gevolg van de verlaagde werktemperatuur.
3.2.3. Waterstofchloride terugwinnen als bijproduct van chlorering
De primaire bron van waterstofchloride en zoutzuur is het bijproduct van chloreringsprocessen. Het kraken van 1,2-dichloorethaan om vinylchloride te produceren, is de belangrijkste bijdrager aan de productie van waterstofchloride.
De hoeveelheden waterstofchloride die worden gegenereerd en verbruikt, kunnen aanzienlijk zijn. Veel faciliteiten produceren ongeveer 10.000 m³/u (16 t/u of 140.000 t/a) of meer.
Bijgevolg wordt waterstofchloride vaak rechtstreeks geleverd aan chemische fabrieken die het als grondstof gebruiken. De opslagcapaciteit voor waterstofchloride is doorgaans relatief klein. Daarom is het van cruciaal belang om een evenwichtige productie- en consumptiesnelheid te handhaven.
In het geval van productieproblemen of marktschommelingen die één fabriek of product treffen, kan de andere fabriek alleen blijven draaien als er reserveproductiecapaciteit (die meestal niet volledig wordt benut) aanwezig is.
Bufferopslag voor vloeibare waterstofchloride wordt gebruikt om kortetermijnonevenwichtigheden tussen productie en consumptie aan te pakken.
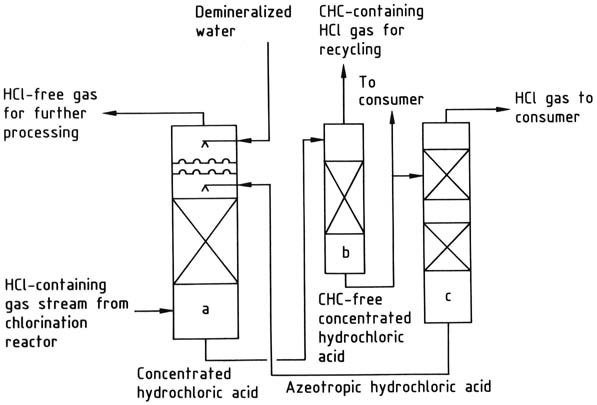
a) Waterstofchloride-absorptiekolom; b) Gechloreerde koolwaterstofstripkolom; c) Waterstofchloride-desorptiekolom
Waterstofchloride geproduceerd door organische chlorering kan verschillende behandelingsmethoden ondergaan:
1. Eenvoudige condensatie van gechloreerde koolwaterstoffen: Deze aanpak wordt gebruikt wanneer de aanwezigheid van resterende gechloreerde koolwaterstoffen of andere bijproducten van het chloreringsproces geen problemen oplevert voor het waterstofchloride, dat als gas wordt geleverd.
Het bereikte zuiveringsniveau is afhankelijk van de condensatiedruk en -temperatuur. Bijvoorbeeld, bij de chlorering van chloormethaan tot dichloormethaan wordt het resulterende waterstofchloride uitsluitend gebruikt om methanol om te zetten in chloormethaan, dat vervolgens wordt gebruikt om dichloormethaan te produceren.
2. Isolatie en zuivering van waterstofchloride door destillatie: Fractionele destillatie van het vloeibaar gemaakte gas kan worden gebruikt wanneer een zuiverder product vereist is. Bijvoorbeeld, de gasvormige producten die afkomstig zijn van het kraken van 1,2-dichloorethaan worden vloeibaar gemaakt en vervolgens gescheiden door destillatie in vinylchloride en waterstofchloride.
Het vloeibaar maken van deze gassen bij extreem lage temperaturen is economisch onpraktisch, dus condensatie en destillatie worden uitgevoerd onder verhoogde druk. Een voordeel van deze methode is dat waterstofchloridegas wordt geproduceerd bij een voldoende hoge druk (meestal 1-2 MPa) voor verdere verwerking, waardoor de noodzaak voor extra mechanische compressie wordt geëlimineerd.
3. Waterige absorptie van waterstofchloride: Deze methode resulteert in de productie van zoutzuur als tussenproduct, maar brengt uitdagingen met zich mee met betrekking tot bouwmaterialen.
De introductie van fluorpolymeren heeft deze problemen echter grotendeels verzacht. Niettemin hebben veel installaties de waterige behandeling vervangen door niet-waterige methoden, zoals fractionele destillatie.
Waterstofchloride kan worden geabsorbeerd met behulp van water of een 20 gew.% zoutzuuroplossing. Water is geschikt wanneer het primaire doel is om 30-35 gew.% zoutzuur als eindproduct te produceren.
Als de vraag naar dergelijk zuur onvoldoende is, wordt de 20% azeotroop gebruikt voor waterstofchloride-absorptie, waardoor het zuur wordt geconcentreerd tot een concentratie van 30-35 gew.%.
Het geconcentreerde zoutzuur wordt indien nodig gezuiverd en vervolgens gedestilleerd om gasvormig waterstofchloride en azeotroop zoutzuur te verkrijgen. Het waterstofchloride wordt gedroogd en aan de consument geleverd, terwijl de azeotroop wordt gerecycled naar de absorptiefase.
Als de aanwezigheid van gechloreerde koolwaterstoffen in zoutzuur ongewenst is, kan een stripstap worden geïmplementeerd om ze te verwijderen.
Om waterstofchloride uit een gasstroom te verwijderen, wordt een kleine hoeveelheid water in de absorptiekolom geïntroduceerd. Deze toevoeging van water zorgt ervoor dat de gasstroom vrij wordt van waterstofchloride. Er moet echter een overeenkomstige hoeveelheid zuur worden gescheiden voor andere doeleinden.
Verschillende proces- en apparatuurparameters zijn cruciaal voor het evalueren van de economie van waterige absorptie van waterstofchloride uit een productiegasstroom:
- De concentratie waterstofchloride in de gasstroom bepaalt de druk en temperatuur die in de absorptiekolom worden gehandhaafd.
- De energie die nodig is om zuiver waterstofchloridegas vrij te maken, neemt af naarmate de concentratie van het gevormde geconcentreerde zuur toeneemt.
- Het produceren van geconcentreerd zoutzuur uit een gasstroom met een lage waterstofchlorideconcentratie vereist aanzienlijke inspanning. Dit kan het verhogen van de druk, het verlagen van de temperatuur of beide inhouden.
- De aanwezigheid van een hoge concentratie waterdamp in de productiegasstroom kan de productie van geconcentreerd zoutzuur onder bepaalde omstandigheden onmogelijk maken.
Een voorgestelde aanpak voor het absorberen van lage niveaus waterstofchloride uit gas met hoge niveaus waterdamp is het gebruik van een magnesiumchlorideoplossing.
De keuze van bouwmaterialen voor waterstofchlorideabsorptieapparatuur is beperkt vanwege de potentiële aanval door zowel geconcentreerd zoutzuur als gechloreerde koolwaterstoffen. Grafietwarmtewisselaars worden gebruikt om het zuur te koelen.
Voor pompen is een speciaal keramisch materiaal traditioneel de economisch haalbare keuze. De destillatiekolom is bekleed met zuurbestendige stenen of grafietblokken, waarbij de stenen worden gecementeerd met fenolhars.
Een zuurbestendige rubberen voering wordt vaak aangebracht tussen de stalen behuizing en de bakstenen muur om zuuraantasting door poriën en scheuren te voorkomen.
Apparatuur die volledig is gemaakt van fenolhars vertoont een uitstekende chemische bestendigheid, maar is broos en mechanisch kwetsbaar, en vereist doorgaans ondersteuning, zoals een buitenmantel van glasvezelversterkte polyesterhars. Dit type apparatuur is geschikt voor gebruik bij atmosferische of iets hogere druk.
Soortgelijke overwegingen gelden voor de gechloreerde koolwaterstofstripkolom. Als de concentratie van gechloreerde koolwaterstoffen laag is of als ze effectief uit het zuur zijn verwijderd, kunnen andere materialen zoals poly(vinylchloride) worden gebruikt voor opslagvaten.
De desorptiekolom is echter gemaakt van grafiet vanwege de hoge bedrijfstemperatuur. Als alternatief kunnen kolommen met rubbervoering en binnenbekleding van baksteen worden gebruikt.
Stalen kolommen bekleed met perfluoropolymeer, met name polytetrafluorethyleen (PTFE), hebben uitstekende resultaten laten zien, hoewel er productvariaties tussen verschillende fabrikanten kunnen bestaan met betrekking tot microporositeit, scheurweerstand en stromingseigenschappen.
Gecoate stalen kolommen bieden voordelen ten opzichte van grafietkolommen omdat ze kunnen werken bij verhoogde druk, maar een defect van de PTFE-voering zou leiden tot snelle vernietiging van de stalen behuizing. Deze kolommen kunnen worden geconstrueerd met behulp van kleine afzonderlijke elementen die snel kunnen worden vervangen, waardoor de onderhoudsuitvaltijd tot een minimum wordt beperkt.
Warmtewisselaars zijn in alle gevallen gemaakt van grafiet. Tantaalvoering en verdampers zijn ook mogelijk, maar er moeten voorzorgsmaatregelen worden genomen om verbrossing door waterstofabsorptie te voorkomen. Bovendien mag waterstoffluoride niet aanwezig zijn.
Volledig droge waterstofchloride corrodeert geen stalen leidingen of compressoren. Vroeger werd geconcentreerd zwavelzuur gebruikt om waterstofchloridegas te drogen. Een andere aanpak maakt gebruik van de eigenschappen van het HCl-H2O-systeem.
Bij lage temperaturen is de partiële dampspanning van water boven sterk geconcentreerd zoutzuur erg laag, waardoor waterstofchloride kan worden gedroogd door het te koelen tot voldoende lage temperaturen onder nul.
Bij licht verhoogde druk (P ≈ 0,3 MPa) is het bereiken van -10 °C meestal voldoende voor bevredigende resultaten. Zoutzuurnevel moet echter volledig worden verwijderd om ernstige corrosie te voorkomen.
3.2.4. Terugwinning van waterstofchloride uit afvalverbranding
Alle chloreringsprocessen resulteren onvermijdelijk in de vorming van ongewenste gechloreerde koolwaterstoffen naast de gewenste producten. Deze onbruikbare en vaak schadelijke stoffen moeten om milieuredenen worden afgevoerd.
Een mogelijke methode is verbranding, waarbij de gechloreerde koolwaterstoffen worden omgezet in waterstofchloride, water en koolstofdioxide. Het terugwinnen van het waterstofchloride is essentieel voor zowel economische als milieuoverwegingen.
Hoewel de specifieke technieken die worden gebruikt kunnen variëren, blijft het onderliggende principe hetzelfde. Verbranding vindt plaats in een oven die is bekleed met vuurvaste materialen bij temperaturen boven de 1000 °C.
Afval van gechloreerde koolwaterstoffen die doorgaans tot 70 gew.% chloor bevatten, vertonen doorgaans goede verbrandingseigenschappen. Echter, verdere toename van het chloorgehalte verlaagt de calorische waarde in die mate dat het verbrandingsproces de toevoeging van stookolie of gas vereist om het te ondersteunen.
Optimale reactieomstandigheden vallen binnen het volgende bereik:
1. Er moet een overmaat aan zuurstof aanwezig zijn om volledige ontleding van de gechloreerde koolwaterstoffen te garanderen. Het resulterende waterstofchloridegas kan vervolgens reageren met deze zuurstof volgens de Deacon-vergelijking:
2 HCl + 0,5 O2 ↔ Cl2 + H2O
Door de temperatuur te verhogen verschuift het evenwicht naar links, wat de vorming van waterstofchloride bevordert. De temperatuur wordt zo hoog mogelijk gehouden voor bouwmaterialen om de vorming van chloor te voorkomen.
Zelfs bij een hoge partiële druk van water en een laag zuurstofoverschot is een temperatuur boven de 1000 °C nodig om de gewenste verschuiving in evenwicht te bereiken. Deze aanpak helpt om het chloorgehalte binnen een acceptabel bereik te houden en zorgt voor een volledige verbranding.
2. De reactietemperatuur mag niet hoger zijn dan 1200 °C om de vorming van stikstofoxiden te voorkomen. Deze oxiden zouden het zoutzuurproduct verontreinigen en uitdagingen opleveren voor de zuivering van afvalgas. Het gebruik van zuivere zuurstof in plaats van lucht kan een mogelijke oplossing zijn.
Om deze redenen vindt verbranding van afvalgechloreerde koolwaterstoffen doorgaans plaats tussen 1000 en 1200 °C. Het koelen van de rookgassen en het genereren van stoom kan uitdagingen opleveren met betrekking tot bouwmaterialen. Het is belangrijk om de afwezigheid van corrosieve verbrandingsproducten te garanderen.
Het behandelde afval moet een bekende samenstelling hebben, inclusief sporenverontreinigingen, om de verwachte verbrandingsproducten, hun concentraties en gedrag nauwkeurig te voorspellen. Snelle koeling heeft de voorkeur om chloorreformatie te voorkomen, omdat langzame koeling kan leiden tot chloorreformatie.
Waterstofchloride wordt uit de verbrandingsgassen teruggewonnen door absorptie. Het terugwinningsproces is vergelijkbaar met dat van chloreringsprocessen, met een paar uitzonderingen:
- Een droog proces is niet mogelijk omdat er altijd waterdamp aanwezig is.
- De gassen moeten worden gecondenseerd op een manier die de vorming van het meest geconcentreerde zoutzuur mogelijk maakt. Dit maakt het mogelijk om gasvormig waterstofchloride of geconcentreerd zoutzuur terug te winnen. Verdund zoutzuur heeft een beperkte commerciële waarde.
- Speciale corrosieproblemen moeten worden aangepakt bij potentiële zuurcondensatiepunten, die mogelijk niet regelmatig voorkomen, maar nog steeds risico’s kunnen opleveren.
- Als de gasvormige verbrandingsproducten direct worden gebruikt, moet de bedrijfstemperatuur altijd boven de condensatietemperatuur van zoutzuur worden gehouden.
Een van de oudste fabrieken die commerciële hoeveelheden 33 gew.% zoutzuur produceert door de verbranding van gechloreerde koolwaterstoffen, bevindt zich in St. Auban, Frankrijk, en wordt beheerd door Atochem. Deze fabriek, opgericht in 1975, verbruikt ongeveer 16.000 ton gechloreerd koolwaterstofmateriaal per jaar.
3.3. Zuivering van zoutzuur
Geactiveerde kool kan effectief verschillende onzuiverheden in waterstofchloridegas verwijderen, waaronder SO2, As en Cl2, door adsorptie. Naarmate het belang van het sulfaatproces afneemt, wordt het verwijderen van gechloreerde koolwaterstoffen uit waterstofchloridegas of zoutzuur praktischer relevant.
Gasvormig waterstofchloride kan worden gezuiverd door middel van lagetemperatuur-scrubbing met behulp van een hoogkokend oplosmiddel, dat een andere gechloreerde koolwaterstof kan zijn (bijv. hexachloorbutadieen of tetrachloorethaan) of specifieke oliefracties. Na een dergelijke behandeling is het gebruik van geactiveerde kool vaak overbodig.
Chloor kan worden verwijderd door koolstoftetrachloride te gebruiken, omdat het aanzienlijk beter oplosbaar is in koolstoftetrachloride vergeleken met waterstofchloridegas.
Zoutzuur, of het nu direct wordt gebruikt of voor de productie van waterstofchloride, bevat voornamelijk vluchtige onzuiverheden zoals gechloreerde koolwaterstoffen. In dergelijke gevallen kunnen deze onzuiverheden uit het zuur worden verwijderd door middel van strippen.
Strippen met een inerte gasstroom is een haalbare optie die resulteert in een lager energieverbruik. In de meeste gevallen heeft het echter de voorkeur om het gas te verwarmen om milieuredenen. Anorganische onzuiverheden, met name ijzer, kunnen worden verwijderd door middel van ionenuitwisseling.
4. Toepassingen van zoutzuur
Zoutzuur en waterstofchloride zijn essentiële chemicaliën in verschillende industriële processen.
Het grootste deel van waterstofchloride wordt doorgaans direct door de producent gebruikt, omdat het bijproduct van organische chloreringsprocessen volledig moet worden benut. Dit wordt bereikt door oxychlorering of hydrochlorering technieken, of in sommige gevallen, chloorwinningsmethoden zoals het KEL-proces, het gemodificeerde Deacon-proces of elektrolyse van zoutzuur.
Waterig zoutzuur vindt uitgebreide toepassingen als een sterk anorganisch zuur. Het wordt gebruikt bij de productie van chloriden, het oplossen van mineralen, het beitsen en etsen van metalen, het regenereren van ionenuitwisselingsharsen voor waterbehandeling, het neutraliseren van alkalische producten of afvalstoffen, het verzuren van pekel in chloor-alkali-elektrolyse en vele andere industriële processen.
5. Toxicologie en gezondheid op het werk
Waterstofchloride staat erom bekend ernstige irritatie aan de ogen, luchtwegen en huid te veroorzaken, zij het in mindere mate. Blootstelling aan de damp kan leiden tot keratoconjunctivitis en inademing kan leiden tot irritatie en schade aan slijmvliezen. De geur van waterstofchloride kan doorgaans worden waargenomen bij concentraties van 1-5 ppm, en wordt onaangenaam bij 5-10 ppm.
Langdurige blootstelling op het werk aan hoge niveaus waterstofchloride kan het risico op chronische bronchitis, maag- en darmklachten en tandbederf vergroten, zelfs bij ogenschijnlijk aanvaardbare concentraties. Concentraties van meer dan 10 ppm kunnen sterke irritatie veroorzaken, zelfs bij acclimatisatie.
Personeel dat met zoutzuur werkt, moet geschikte beschermende brillen, kleding, rubberen handschoenen en laarzen dragen. Inademing van de damp moet worden vermeden en ademhalingsfilters die zijn ontworpen voor anorganische gassen worden aanbevolen.
In de Bondsrepubliek Duitsland gelden de voorschriften voor de bestrijding van gevaarlijke stoffen voor waterstofchloride en zoutzuur (>10 gew.%), in overeenstemming met de EEG-richtlijnen. Deze voorschriften specificeren gevarensymbolen, veiligheidsinstructies en voorzorgsmaatregelen voor het hanteren van deze stoffen.
Bij contact met de huid of ogen is onmiddellijk en grondig spoelen met water essentieel. Verontreinigde kleding moet op dezelfde manier worden behandeld en alkalische reinigingsoplossingen mogen worden gebruikt.
Bij het werken met waterstofchloride, vooral bij verhoogde druk, is het cruciaal om direct beschikbare ademhalingsapparatuur met onafhankelijke luchttoevoer en volledige beschermende kleding te hebben in geval van ongevallen.
In Duitsland is de maximaal toegestane concentratie (MAK) voor waterstofchloride 5 ppm per volume, wat overeenkomt met 7 mg/m³. Dezelfde waarden dienen als de drempelwaarde (TLV) in de Verenigde Staten. In de Sovjet-Unie is de vastgestelde limiet 3 ppm (5 mg/m³).
Regelgeving voor schone lucht specificeert concentratielimieten voor waterstofchloride in de atmosfeer, zoals 0,1 mg/m³ als jaarlijks gemiddelde en 0,2 mg/m³ voor korte periodes. Verschillende plantensoorten vertonen verschillende toleranties voor blootstelling aan waterstofchloride.
Wat betreft industriële afvalgassen mag de waterstofchlorideconcentratie volgens de Duitse regelgeving over het algemeen niet hoger zijn dan 30 mg/m³, hoewel de limiet 50 mg/m³ is voor afvalverbrandingsinstallaties. De kosten van gasreiniging kunnen hierdoor aanzienlijk variëren.
Waterreiniging is vaak voldoende voor het verwijderen van waterstofchloride, maar er kunnen meerdere stappen nodig zijn, waaronder een laatste reiniging met een alkalische oplossing.
In sommige gevallen kan er geen commercieel zoutzuur worden geproduceerd en wordt het verdunde zuur geneutraliseerd voordat het in afvalwater wordt geloosd. Neutralisatie met natronloog kan af en toe een zoutoplossing opleveren die zuiver genoeg is voor recycling naar een chloorfabriek.
Referentie
- Zoutzuur; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_283
