Zinkoxide: eigenschappen, productie en toepassingen

Wat is zinkoxide?
Zinkoxide is een anorganische verbinding met de chemische formule ZnO. Het is een wit poeder dat onoplosbaar is in water. Hoewel het van nature voorkomt als het mineraal zinkiet, wordt het meeste zinkoxide dat commercieel wordt gebruikt synthetisch geproduceerd.
Vroeger werd zinkoxide alleen gebruikt als wit pigment, bekend onder verschillende namen, waaronder zinkwit (C.I. Pigment White 4), Chinees wit en zinkbloemen.
Zinkoxide ontstond als een bijproduct van het smelten van koper. De oude Romeinen noemden het “cadmia” en gebruikten het bij de productie van messing. Ze verfijnden het ook door middel van een reductie-oxidatieproces voor medicinale zalven. Middeleeuwse alchemisten dachten dat cadmia in goud kon worden omgezet.
Halverwege de 18e eeuw produceerde de Duitse chemicus Cramer zinkoxide door metallisch zink te verbranden. Courtois begon in 1781 met de productie van zinkwit in Frankrijk; De productie op industriële schaal begon echter pas in 1840 door Leclaire met behulp van het indirecte, of Franse, proces.
Zinkoxide verving loodwit snel vanwege zijn superieure eigenschappen, zoals niet-giftigheid, weerstand tegen verkleuring door zwavelhoudende gassen en een goede opaciteit.
Rond 1850 ontwikkelde S. Wetherill van de New Jersey Zinc Company een roostoven waarin een met kolen beladen rooster werd gevuld met kolen en vervolgens bedekt met een mengsel van zinkerts en kolen. Zink onderging reductie door gedeeltelijke verbranding van de kolen en oxideerde vervolgens opnieuw bij het verlaten van de oven.
Deze methode werd bekend als het directe, of Amerikaanse, proces. Hoewel deze ovens later werden verbeterd, zijn ze niet meer in gebruik.
In de tweede helft van de 19e eeuw werd zinkoxide toegevoegd aan rubberformuleringen om de vulkanisatietijd te verkorten. De ontdekking van organische versnellers in 1906 zorgde voor een aanzienlijke verbetering van het vulkanisatieproces, waardoor zinkoxide steeds belangrijker werd en als activator in de rubberindustrie werd gebruikt.
Inhoudsopgave
1. Fysische eigenschappen van zinkoxide
Zinkoxide is een fijn wit poeder dat geel wordt bij verhitting boven 300 °C. Het absorbeert ultraviolet (UV) licht met golflengten lager dan 366 nm.
De toevoeging van sporen monovalente of trivalente elementen aan het kristalrooster verleent het halfgeleidende eigenschappen. Elementaire deeltjes van ZnO, geproduceerd via thermische methoden, kunnen korrelig, nodulair (0,1-5 µm) of naaldvormig (naaldvormig) zijn.
ZnO is onoplosbaar in water, met een oplosbaarheid van ongeveer 0,16 mg/100 ml bij 30 °C; het lost echter wel op in verdunde zuren en sterke basen vanwege zijn amfotere aard.
Belangrijke fysische eigenschappen van zinkoxide worden samengevat in de onderstaande tabel:
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [1314-13-2] |
| Chemische formule | ZnO |
| Molecuulgewicht | 81,38 g/mol |
| Smeltpunt | 1975 °C |
| Kookpunt | ongeveer 2360 °C |
| Dichtheid | 5,65–5,68 g/cm3 |
| Breukindex | 1,95–2,1 |
| Warmtecapaciteit bij 25 °C | 40,26 J mol-1 K-1 |
| Warmtecapaciteit bij 100 °C | 44,37 J mol-1 K-1 |
| Warmtecapaciteit bij 1000 °C | 54,95 J mol-1 K-1 |
| Thermische geleidbaarheid | 25,2 W m-1 K-1 |
| Kristalstructuur | hexagonaal, wurtziet |
| Hardheid volgens Mohs-schaal | 4–4,5 |
| Olie-absorptiewaarde | 20–24 g/100 g |
| Schijnbare dichtheid | 100 cm³/100 g |
| Gemiddelde deeltjesgrootte | 0,11–0,22 mm |
| BET-oppervlak | 3–10 m²/g |
2. Chemische eigenschappen van zinkoxide
Zinkoxide is amfoteer. Het reageert met zowel organische als anorganische zuren. Het lost ook op in alkalische oplossingen en ammoniak om zinkaten te vormen. ZnO reageert gemakkelijk met zure gassen, zoals koolstofdioxide, zwaveldioxide en waterstofsulfide. Reacties bij hoge temperaturen met andere oxiden leveren verbindingen op zoals zinkferrieten.
Het reageert met zuren om zinkzouten en water te produceren. Dit is een neutralisatiereactie waarbij ZnO als base fungeert.
ZnO + 2 HCl → ZnCl2 + H2O
ZnO + H2SO4 → ZnSO4 + H2O
ZnO + 2 HNO3 → Zn(NO3)2 + H2O
Zinkoxide reageert met sterke basen tot oplosbare zinkaten. ZnO fungeert in deze reacties als een zuur.
ZnO + 2 NaOH → Na2ZnO2 + H2O (natriumzinkaat)
Zinkoxide kan worden gereduceerd tot metallisch zink met behulp van hoge temperaturen en een reductiemiddel. Het is een standaardstap in de extractie van zinkerts.
Koolstof (cokes) reduceert zinkoxide tot zinkmetaal, en koolstof wordt geoxideerd tot koolmonoxide. Deze reactie is van historische en industriële betekenis.
Waterstof of reactieve metalen zoals magnesium kunnen ook zinkoxide reduceren.
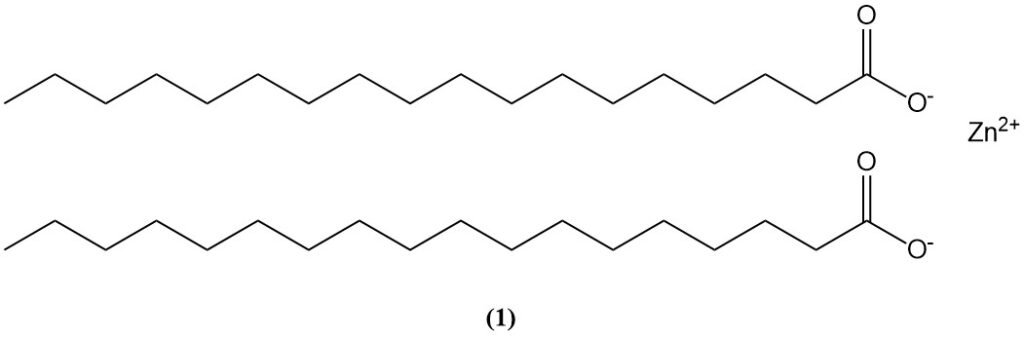
Zinkoxide reageert met veel organische verbindingen, met name carbonzuren en vetzuren (bijv. stearinezuur, dat voorkomt in oliën en rubberformuleringen), om zinkcarboxylaten (zinkzepen) te vormen.
Zinkstearaat (1), gevormd door de reactie van stearinezuur met zinkoxide, wordt gebruikt als versneller-activator en kan ook bijdragen aan de afbraak van olieverf die ZnO-pigment bevat.
Zinkoxide is thermisch stabiel, maar kan dissociëren bij extreem hoge temperaturen. Deze thermische ontleding is een belangrijke stap in bepaalde thermochemische cycli voor waterstofproductie.
3. Industriële productie van zinkoxide
Industrieel wordt zinkoxide voornamelijk geproduceerd via twee hoofdprocessen: het indirecte proces (Frans proces) en het directe proces (Amerikaans proces). Een kleinere hoeveelheid wordt ook geproduceerd via natchemische processen.
Het natte proces is goed voor ongeveer 1-2% van de zinkoxideproductie. Het directe proces draagt 10-20% bij en het indirecte proces levert het resterende deel.
Vroeger bestonden de grondstoffen voor het directe proces voornamelijk uit zinkertsen of -concentraten. Het indirecte proces gebruikte nieuw metallisch zink van producenten. De huidige zinkoxideproductie maakt voornamelijk gebruik van residuen en secundair zink.
Dit feit, in combinatie met de vraag van gebruikers naar een hoge chemische zuiverheid, leidde tot procesaanpassingen en het gebruik van verschillende zuiveringstechnieken.
3.1. Productie van zinkoxide via een direct of Amerikaans proces
Het directe, of Amerikaanse, proces voor de productie van zinkoxide wordt gekenmerkt door zijn eenvoud, kosteneffectiviteit en hoge thermische efficiëntie. Het omvat de initiële reductie bij hoge temperatuur (1000-1200 °C) van zinkhoudende materialen. Steenkool wordt gebruikt als reductiemiddel. De reductie vindt plaats volgens de reacties van Boudouard:
ZnO + C ⇌ Zn + CO
ZnO + CO ⇌ Zn + CO
2 C + O2 ⇌ CO
2 CO2 + C ⇌ 2 CO
Zinkdamp en koolmonoxidegas ondergaan vervolgens oxidatie tot zinkoxide en kooldioxide boven het reactiebed of bij de uitgang van de oven.
Er worden verschillende zinkhoudende grondstoffen gebruikt. Deze omvatten zinkconcentraten, metallisatieresiduen, het bijproduct zinkhydroxide en, voornamelijk, zinkslakken afkomstig van gietovens of galvanisatieprocessen. Slakken moeten worden voorbehandeld door verhitting tot ongeveer 1000 °C in draaiovens om chloride- en loodverontreinigingen te verwijderen.
Momenteel worden alleen draaiovens gebruikt voor het directe proces. Statische ovens zijn niet langer in gebruik. Grondstoffen bevatten doorgaans zink in een bereik van 60% tot 75%. Er bestaan twee hoofdtypen draaiovens: lange, smalle ovens en kortere, bredere ovens.
1. Lange, smalle ovens: Deze ovens zijn ongeveer 30 m lang en 2,5 m in diameter en worden verhit met gas of olie. De grondstof, een mengsel van zinkhoudende substantie en steenkool, wordt continu in tegenstroom of gelijkstroom met de verbrandingsgassen toegevoerd.
Residuen, die restzink en onverbrande steenkool bevatten, verlaten de oven continu aan de kant tegenover het toevoerpunt. Overtollige steenkool wordt gezeefd en gerecycled. Verbrandingsgassen, bestaande uit zinkdamp, ZnO en CO, komen in een kamer terecht waar de oxidatie wordt voltooid en grote onzuiverheidsdeeltjes bezinken.
De gassen worden vervolgens gekoeld via een warmtewisselaar of luchtverdunning. Zinkoxide wordt vervolgens opgevangen in zakfilters.
2. Kortere, bredere ovens: Dit type draaitrommeloven is ongeveer 5 m lang en 3 m in diameter. De toevoer van grondstoffen vindt continu plaats; ontzinkte resten worden echter batchgewijs verwijderd.
De bedrijfsomstandigheden voor beide oventypen worden nauwkeurig gecontroleerd om een hoge opbrengst en het bereiken van de gewenste deeltjesvorm en -grootte te garanderen. De chemische zuiverheid, ervan uitgaande dat er geen externe verontreiniging is, wordt uitsluitend bepaald door de samenstelling van de oorspronkelijke grondstoffen.
3.2. Productie van zinkoxide via indirect of Frans proces
In het indirecte, of Franse, proces wordt het zink gekookt en ondergaat de gevormde zinkdamp oxidatie door verbranding in lucht onder gecontroleerde parameters. De kristallografische en fysische eigenschappen van het gegenereerde zinkoxide kunnen worden aangepast door de verbrandingsomstandigheden, zoals vlamturbulentie en luchtovermaat, te wijzigen.
De chemische samenstelling van het ZnO-product is uitsluitend afhankelijk van de samenstelling van de zinkdamp.
Diverse oventypen maken de productie van zinkdamp met de vereiste zuiverheid uit verschillende grondstoffen mogelijk, wat een hoge zinkopbrengst garandeert.
De grondstoffen die in dit proces worden gebruikt, zijn onder andere zuiver zink (superhoogwaardig zink, SHG; hoogwaardig zink, HG) en, in toenemende mate, metaalresten (bijv. zinkschroot, spuitgietslakken, galvaniseerslakken). Vóór de oxidatie verwijderen scheidingstechnieken in de vloeistoffase of dampfase onzuiverheden zoals cadmium, lood, ijzer en aluminium uit het zinkmetaal.
Specifieke methoden voor zinkverdamping en -zuivering omvatten:
1. Moffelovens of retorten (grafiet/siliciumcarbide): De metaalgrondstof wordt in de oven gebracht als vaste batches of continue vloeistofstromen. Verdampingswarmte wordt geleverd door externe verhitting van de retort met een brander.
Niet-vluchtige residuen, zoals ijzer en lood uit smeltafval, hopen zich op in de retort. Periodieke verwijdering van deze residuen is noodzakelijk, vaak door de retorten te kantelen.
2. Gefractioneerde destillatie: Zinkdamp, die onzuiverheden zoals Cd, Pb, Fe, Al en Cu bevat, kan worden gezuiverd via gefractioneerde destillatie. Dit proces vindt plaats in kolommen, vaak uitgerust met siliciumcarbideplaten (bijv. het ontwerp van New Jersey Zinc Co.). Oxidatie van de gezuiverde zinkdamp vindt plaats aan de uitgang van de kolom.
3. Ovens met twee kamers: Metaalhoudende grondstof, voornamelijk in grote stukken, komt een primaire smeltkamer binnen, die is verbonden met een secundaire, elektrisch verwarmde kamer. Destillatie vindt plaats in de tweede kamer, in een luchtvrije omgeving.
Niet-metalen residuen worden van het oppervlak van de smeltkamer verwijderd. Onzuiverheden, waaronder ijzer, aluminium en een deel van het lood, hopen zich op in de destillatiekamer en worden periodiek in vloeibare vorm verwijderd. Resterende loodsporen worden vervolgens verwijderd door gefractioneerde destillatie. Lundevall ontwikkelde de eerste versie van dit type oven.
4. Smelten in een draaioven: Indirect zinkoxide kan ook worden geproduceerd door middel van een smeltproces in een draaioven, met dezelfde grondstoffen. Het smelten, de destillatie en een deel van de oxidatie vinden plaats in één reactiezone, waardoor een groot deel van de verbrandingswarmte van het zink kan worden benut.
Door de temperatuur en de partiële druk van koolstofdioxide en zuurstof te regelen, kan het gehalte aan loodverontreinigingen worden beperkt en kunnen de vorm en grootte van de ZnO-deeltjes worden aangepast, zij het met minder precisie dan bij andere methoden.
3.3. Productie van zinkoxide via het natte proces
Zinkoxide wordt geproduceerd via het natte proces, waarbij basisch zinkcarbonaat neerslaat uit gezuiverde zinksulfaat- of chlorideoplossingen. Het neerslag wordt gewassen en gefilterd en vervolgens gecalcineerd om zinkoxide te vormen. Deze methode produceert ZnO met een hoog specifiek oppervlak.
Vergelijkbare producten worden verkregen uit afvalhydroxiden, die chemisch worden gezuiverd en vervolgens gecalcineerd.
3.4. Nabehandeling
Thermische nabehandeling, bij temperaturen tot 1000 °C, verbetert de pigmenteigenschappen van ZnO en wordt voornamelijk toegepast op oxide dat via de directe methode wordt geproduceerd. Gecontroleerde atmosferische calcinatie verbetert de fotogeleidende eigenschappen van hoogzuiver oxide verder. Dit hoogzuivere oxide wordt gebruikt in kopieertoepassingen.
Het oppervlak van zinkoxide kan organofieler worden gemaakt door het te coaten met olie en propionzuur. Zinkoxide ondergaat vaak ontluchting. Het wordt soms gepelletiseerd of gegranuleerd om de verwerkingseigenschappen te verbeteren.
| A | B | C | D | |
|---|---|---|---|---|
| Parameter | Indirect proces | Indirect proces | Direct proces | Nat proces |
| ZnO (min.), gew.% | 99,5 | 99 | 98,5 | 93 |
| Pb (max.), gew.% | 0,004 | 0,25 | 0,25 | 0,001 |
| Cd (max.), gew.% | 0,001 | 0,05 | 0,03 | 0,001 |
| Cu (max.), gew.% | 0,0005 | 0,003 | 0,005 | 0,001 |
| Mn (max.), gew.% | 0,0005 | 0,001 | 0,005 | 0,001 |
| In water oplosbare zouten (max.), gew.% | 0,02 | 0,1 | 0,65 | 1 |
| Verlies bij gloeien (max.), gew.% | 0,3 | 0,3 | 0,3 | 4 |
| Zuurgraad, g H2SO4/100 g | 0,01 | 0,1 | 0,3 | 0,2 |
| Soortelijk oppervlak, m2/g | 3–8 | 3–10 | 1–5 | 25 (min.) |
4. Toepassingen van zinkoxide

Zinkoxide kent vele toepassingen. Veruit de belangrijkste is de rubberindustrie. Bijna de helft van de ZnO wereldwijd wordt gebruikt als activator voor vulkanisatieversnellers in natuurlijk en synthetisch rubber.
4.1. Gebruik van zinkoxide bij de productie van natuurlijk en synthetisch rubber
De toevoeging van zinkoxide aan rubbermengsels die zwavel en versnellers bevatten, verhoogt de vernettingsdichtheid. Voor universeel rubber, waaronder natuurlijk rubber en styreen-butadieenrubber, leveren ZnO-doseringen tot ongeveer 5 phr (delen per honderd rubber) hoge treksterkte- en spanningswaarden op. Hogere doseringen verbeteren deze eigenschappen niet verder.
Vetzuren activeren het rubber-zwavel-versneller-zinkoxidesysteem. Stearinezuur of zinkstearaat wordt vaak gebruikt. De toevoeging van specifieke zinkzouten, naast ZnO, kan de vernettingsdichtheid verhogen en het reversiegedrag verbeteren.
De reactiviteit van zinkoxide hangt af van het specifieke oppervlak, maar ook de aanwezigheid van onzuiverheden, zoals lood en sulfaten, heeft invloed. Zinkoxide zorgt voor een goede duurzaamheid van gevulkaniseerd rubber en verhoogt tevens de thermische geleidbaarheid. Het ZnO-gehalte varieert doorgaans van 2% tot 5%.
4.2. Gebruik van zinkoxide in verf en coatings
Zinkoxide is niet langer het primaire witte pigment in verf en coatings. Het wordt echter nog steeds door kunstenaars gebruikt vanwege de uitstekende witte kleur. Het wordt gebruikt als additief in houtverduurzamingsverven voor buiten en in antifouling- en anticorrosieverven.
Zinkoxide wordt meestal gecombineerd met andere actieve anticorrosieve pigmenten. De remmende werking is gebaseerd op het vermogen om te reageren met corrosieve stoffen en een alkalische pH in de coating te handhaven. Het reageert ook met zure bindmiddelen om zepen te vormen en absorbeert ultraviolet (UV) licht.
Het loodgehalte van commercieel zinkoxide varieert per fabrikant en varieert van 0,002% tot 1,5%. Een loodvrije zinkoxidecoating vereist een loodgehalte van minder dan 1,5%.
Zinkoxide verbetert de filmvorming, duurzaamheid en schimmelbestendigheid. Het vertoont een synergetisch effect met andere fungiciden omdat het kan reageren met de zure oxidatieproducten en UV-straling kan absorberen.
4.3. Gebruik van zinkoxide in de farmaceutische en cosmetische industrie
De farmaceutische en cosmetische industrie gebruikt zinkoxide in poeders en zalven omdat het bacteriedodende eigenschappen heeft. Het werd ook gebruikt om tandcementen te vormen door reactie met eugenol, maar wordt nu nog maar zelden gebruikt.
De reactieve componenten, ZnO en eugenol (80-96 gew.%), worden geleverd als twee pasta’s. Oliën (bijv. olijfolie, minerale olie) en vulstoffen (bijv. talk, kaolien, colofonium, vaseline) regelen de consistentie. Zinkacetaat en magnesiumchloride worden gebruikt als versnellers voor de vorming van zink-eugenolaat.
Zinkoxide wordt ook gebruikt als UV-werend additief voor cosmetica. Het wordt gebruikt als zonnebrandcrème op en in de hoornlaag. Het fungeert als ‘fysieke’ lichtfilter, voornamelijk door zowel UVA- als UVB-straling te reflecteren en te verstrooien, en biedt zo een breedspectrum bescherming. Gemicroniseerd en nano-ZnO wordt vaak gebruikt om de zichtbare witte resten te verminderen.
Het wordt gebruikt als wit pigment voor de productie van gekleurde poeders en parelpigmenten, zoals oogschaduwpoeder.
Zinkoxide wordt gebruikt in diverse huidproducten vanwege de verzachtende, samentrekkende en antiseptische eigenschappen. Voorbeelden hiervan zijn luieruitslagcrèmes, calaminelotion, antiseptische zalven en acnebehandelingen.
4.4. Gebruik van zinkoxide in de keramische en glasindustrie
Zinkoxide wordt gebruikt in de glas-, keramiek- en emailindustrie om het smeltpunt te verlagen en de glans, schittering en scheurbestendigheid te verbeteren (waardoor craqueleren en rillen wordt voorkomen). Het kan ook worden gebruikt om de glans te wijzigen of de opaciteit te verbeteren.
Hogere concentraties ZnO kunnen matte en kristallijne oppervlakken produceren. De hoge warmtecapaciteit en thermische geleidbaarheid zijn gunstig voor de keramische productie.
4.5. Gebruik van zinkoxide als grondstof
Zinkoxide wordt gebruikt als grondstof voor verschillende producten, waaronder stearaten, fosfaten, chromaten, bromaten, organische dithiofosfaten en ferrieten (ZnO, MnO, Fe2O3). Het wordt ook gebruikt bij elektrolytisch verzinken (met name in cyanidebadformuleringen).
Zinkoxide wordt gebruikt als zinkbron in diervoeders en ook voor het ontzwavelen van gassen.
Zinkoxide wordt gebruikt als katalysator in organische syntheses, zoals de productie van methanol, vaak in combinatie met andere oxiden. Het is ook een bestanddeel van sommige lijmen.
4.6. Gebruik van zinkoxide in elektronica
ZnO met de hoogste zuiverheid, gecalcineerd met additieven zoals bismutoxide (Bi2O3), wordt gebruikt bij de productie van varistoren, die worden gekenmerkt door spanningsafhankelijke weerstand, d.w.z. niet-ohms gedrag.
Een typische samenstelling bestaat uit 96,5 massa% ZnO, 0,5% Bi2O3, 1% CoO, 0,5% MnO, 1% Sb2O3 en 0,5% Cr2O3. Het niet-ohmse gedrag is het gevolg van halfgeleidende ZnO-korrels en een dunne isolerende korrelgrensfase.
Een metaaloxidevaristor op basis van bismut-gedoteerd ZnO is superieur aan de klassieke siliciumcarbide (SiC)-varistoren omdat de spanning-stroomkarakteristieken een veel lagere helling hebben, wat resulteert in een veel lagere spanningsstijging per eenheid stroomtoename.
De fotogeleidende eigenschappen van ZnO worden benut in fotoreproductieprocessen. Dotering met aluminiumoxide vermindert de elektrische weerstand, waardoor het kan worden gebruikt in coatings op masterpapier voor offsetreproductie.
Zinkoxide is een halfgeleider met een brede bandgap (3,3 eV). Deze eigenschap maakt het geschikt voor:
- UV-lasers en leds, met name voor opto-elektronische toepassingen met een korte golflengte.
- Gassensoren, vanwege de gevoeligheid voor verschillende gassen.
- Transparante geleidende elektroden in apparaten zoals zonnecellen (bijvoorbeeld als bufferlaag in CIGS-zonnecellen).
- Transistoren en diodes.
- Piëzo-elektrische apparaten, onderzocht voor sensoren en energieopwekking.
5. Toxicologie van zinkoxide
In tegenstelling tot andere zware metalen is zink niet geclassificeerd als inherent giftig of gevaarlijk. Het is een essentieel element voor de fysiologie van mens, dier en plant. Het menselijk lichaam bevat ongeveer 2 gram zink. Een dagelijkse inname van 10-20 mg wordt aanbevolen.
De orale LD50 voor ratten is 630 mg/kg. De toegestane concentraties zinkoxidestof in de werklucht bedragen 5 mg/m³ (MAK) en 10 mg/m³ (TLV-TWA). Voor zinkoxidedampen bedragen de waarden 5 mg/m³ (TLV-TWA) en 10 mg/m³ (TLV-STEL).
De grenswaarden voor beroepsmatige blootstelling (OEL’s) voor zinkoxide staan vermeld in Tabel 3.
| Land | 8-uurs TWA, mg/m3 | 15-min STEL, mg/m3 | Referenties |
|---|---|---|---|
| VS | 5 (dampen), 10 (stof) | 10 (dampen) (plafond) | ACGIH (1991, richtwaarden) |
| VS | 5 (dampen), 15 (stof; totaal), 5 (stof; inadembaar) | OSHA (1989, wettelijke grenswaarden) | |
| Nederland | 5 (dampen) | SZW (1997) | |
| Duitsland | 5 (dampen), 6 (stof) | DFG (1997) | |
| VK | 5 (dampen), 10 (stof) | HSE (1998) | |
| Zweden | 5 (dampen) | Nationale Raad voor Arbeidsveiligheid en Gezondheid, Zweden (1993) | |
| Denemarken | 4 (dampen), 10 (stof) | Arbejdstilsynet (1992) |
Accidentele inname of inademing van grote hoeveelheden ZnO kan na enkele uren koorts, misselijkheid en irritatie van de luchtwegen veroorzaken. Deze symptomen zijn van voorbijgaande aard en verdwijnen snel zonder blijvende gevolgen.
Referenties
- Pigments, Inorganic, 2. White Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n01.pub2
- Rubber, 9. Chemicals and Additives. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a23_365.pub3
- Pigments, Inorganic, 5. Anticorrosive Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n04
- Pigments, Inorganic, 7. Transparent Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n06
- Dental Materials. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_251.pub2
- Skin Cosmetics. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a24_219
- Ceramics, Electronic. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_079.pub2
- The effect of formulation on the penetration of coated and uncoated zinc oxide nanoparticles into the viable epidermis of human skin in vivo
- Zinc Compounds. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a28_537.pub2
