Productieproces van aceetaldehyde
Aceetaldehyde wordt geproduceerd uit de volgende grondstoffen: ethanol verkregen door de fermentatie van koolhydraten of de hydratatie van ethyleen, acetyleen, ethyleen, lagere koolwaterstoffen, koolmonoxide en waterstof en methanol.
De economische levensvatbaarheid van commerciële processen is afhankelijk van de beschikbaarheid en prijzen van grondstoffen. In sterk geïndustrialiseerde landen, waar het handhaven van hoge prijzen voor ethanol door middel van fiscale maatregelen een uitdaging was of waar petrochemische ethanol niet beschikbaar was (zoals het geval was in Duitsland of Japan vóór 1939), werd acetyleen het favoriete uitgangsmateriaal voor aceetaldehyde.
Het acetyleenproces wordt nog steeds gebruikt in sommige Oost-Europese landen en door bedrijven die toegang hebben tot goedkope acetyleen. In andere landen werd echter petrochemisch geproduceerde ethanol de favoriete grondstof, terwijl ethanol afkomstig van fermentatie in mindere mate werd en nog steeds wordt gebruikt in landen met een minder belangrijke chemische industrie.
In westerse landen, waaronder Japan, zijn deze processen grotendeels vervangen door het directe oxidatieproces dat eind jaren vijftig werd ontwikkeld door Wacker-Chemie en Hoechst. Deze verschuiving vond plaats omdat ethyleen goedkoper verkrijgbaar is dan acetyleen.
Zelfs tweestapsprocessen die ethanol afkomstig van ethyleen als uitgangsmateriaal gebruiken, zijn niet langer concurrerend vanwege het afnemende belang van aceetaldehyde als organisch tussenproduct.
Over het algemeen hebben processen op basis van acetyleen, ethyleen en ethanol een hogere selectiviteit vergeleken met de oxidatie van verzadigde koolwaterstoffen. Dit komt omdat in het laatste geval naast aceetaldehyde ook extra oxidatieproducten worden gevormd.
Deze processen zijn echter alleen economisch rendabel bij grootschalige operaties waarbij alle primaire en secundaire producten die tijdens het proces worden verkregen, worden gebruikt, omdat de scheiding van het productmengsel kostbaar kan zijn.
Inhoudsopgave
1. Productie van aceetaldehyde uit ethanol
Om aceetaldehyde te produceren, zijn er twee methoden met ethanol: dehydrogenering en oxidatie in aanwezigheid van zuurstof. Tussen 1918 en 1939 werd dehydrogenering bevoordeeld vanwege de gelijktijdige productie van waterstof. Later werd echter katalytische dampfase-oxidatie van ethanol het voorkeursproces, waarschijnlijk vanwege de langere levensduur van de katalysator en het potentieel voor energieterugwinning.
1.1. Dehydrogenering van ethanol
De eerste onderzoeken naar de dehydrogenering van ethanol, die in 1886 werden gedocumenteerd, omvatten het leiden van ethanol door glazen buizen bij 260 °C.
CH3CH2OH → CH3CHO + H2 (ΔH = +82.5 kJ/mol)
Verbeterde opbrengsten worden bereikt met katalysatoren zoals platina, koper of zink-, nikkel- of kobaltoxiden. Latere patenten vermelden zink- en chroomkatalysatoren, zeldzame aardmetaaloxiden en mengsels van koper- en chroomoxiden. Koperkatalysatoren leveren de minste hoeveelheid ontledingsproducten op, maar frequente katalysatorregeneratie is noodzakelijk.
1.1.1. Procesbeschrijving
Ethanoldamp wordt door een buisvormige reactor geleid die een katalysator bevat die is samengesteld uit koperspons of koper geactiveerd met chroomoxide bij temperaturen van 260-290 °C. Elke run resulteert in een conversiepercentage van 25-50%.
Aceetaldehyde en ethanol worden gescheiden van het uitlaatgas, voornamelijk bestaande uit waterstof, door middel van alcohol- en waterwassing. Zuivere aceetaldehyde wordt verkregen via destillatie, terwijl ethanol wordt gescheiden van water en producten met een hoger kookpunt door middel van destillatie en wordt teruggevoerd naar de reactor.
De uiteindelijke opbrengst van aceetaldehyde is ongeveer 90%. Bijproducten omvatten boterzuur, crotonaldehyde en ethylacetaat.
1.2. Oxidatie van ethanol
De oxidatie van ethanol is de oudste en meest effectieve laboratoriummethode voor het synthetiseren van aceetaldehyde. In het commerciële proces wordt ethanol katalytisch geoxideerd met zuurstof (of lucht) in de dampfase.
CH3CH2OH + 0.5 O2 → CH3CHO + H2O (ΔH = -242 kJ/mol)
Koper, zilver en hun oxiden of legeringen zijn veelgebruikte katalysatoren.
1.3. Veba-Chemie-proces
In het Veba-Chemie-proces wordt ethanol gecombineerd met lucht en over een zilverkatalysator geleid bij temperaturen van 500 tot 650 °C. De specifieke temperatuur is afhankelijk van de alcohol-luchtverhouding en de gasstroomsnelheid door de katalysator.
De alcoholconversie varieert van 50% tot 70%, terwijl de opbrengst varieert tussen 97% en 99%, afhankelijk van de reactieomstandigheden. Aceetaldehyde en niet-omgezette alcohol worden gescheiden van het afvalgas door middel van koude alcoholwassing en fractionele destillatie.
Na concentratie keert de alcohol terug naar de reactor. De warmte die tijdens de reactie wordt gegenereerd, wordt gebruikt voor stoomproductie met behulp van een afvalwarmteterugwinningssysteem direct na de reactiezone.
Het afvalgas bestaat voornamelijk uit stikstof, waterstof, methaan, koolmonoxide en kooldioxide en wordt verbrand als laagcalorisch arm gas in stoomgeneratoren. Kleine hoeveelheden azijnzuur worden geproduceerd als bijproduct.
2. Productie van aceetaldehyde uit acetyleen
Het gebruik van kwikverbindingen dient als primaire katalysator voor het industriële wateradditieproces (hydratatie) bij de productie van acetyleen.
Om deze methode succesvol industrieel te implementeren, is het belangrijk om de polymerisatie- en condensatieproducten van aceetaldehyde die in een zure omgeving worden gevormd, te elimineren.
In 1912 stelde het Consortium für elektrochemische Industrie een proces voor dat overtollig acetyleen bij een verhoogde temperatuur gebruikte. Het omvatte de onmiddellijke verwijdering van het aceetaldehydeproduct uit de reactievloeistof.
Tegelijkertijd werd de warmte die tijdens de reactie werd gegenereerd, afgevoerd door een geschikte hoeveelheid water te distilleren. Secundaire reacties, zoals de oxidatie van aceetaldehyde tot azijnzuur en koolstofdioxide, resulteerden in de reductie van Hg2+ tot metallisch kwik. De productie van aceetaldehyde uit acetyleen is inmiddels stopgezet in westerse landen.
2.1. Nat oxidatieproces (Hoechst)
Het natte oxidatieproces bood een oplossing om directe verwerking van giftige kwikverbindingen te vermijden. Het werd onder andere door Wacker-Chemie gebruikt tot de overstap naar ethyleen als uitgangsmateriaal in 1962.
Bij deze methode werd ijzer(III)sulfaat toegevoegd om het kwikmetaal te heroxideren tot het kwik(II)zout, waardoor adequate concentraties van de actieve katalysator werden gegarandeerd. Acetyleen reageerde met de waterige katalysatoroplossing bij 90-95 °C.
Ongeveer 30-50% van het geïnjecteerde acetyleen onderging een reactie in elke run. Het gas dat uit de reactor kwam werd gekoeld, wat leidde tot de scheiding van voornamelijk water en sporen kwik, die vervolgens terug naar de reactor werden gebracht.
Aceetaldehyde en water werden gecondenseerd in extra koelers, en de aceetaldehyde werd uiteindelijk uitgewassen met water uit het gekoelde cyclusgas. Dit proces leverde een 8-10% waterige aceetaldehyde-oplossing op.
Stikstof werd ingebracht met het toevoergas, terwijl koolstofdioxide werd geproduceerd als bijproduct. Om overmatige accumulatie te voorkomen, werden deze gassen verwijderd door een kleine stroom van het cyclusgas te onttrekken.
IJzer(II)sulfaat werd gevormd tijdens de reactie en geoxideerd in een aparte reactor met 30% salpeterzuur bij 95 °C. Zuivere aceetaldehyde werd verkregen door fractionele destillatie van de waterige oplossing bij ongeveer 200 kPa.
2.2. Chisso-proces
Het Chisso-proces gebruikte een zwavelzuur/kwiksulfaatoplossing als katalysator. Het acetyleen reageerde volledig met de katalysatoroplossing bij 68-78 °C en een manometerdruk van 140 kPa.
Een combinatie van druk- en vacuümprocesstappen, uitgevoerd bij lage temperaturen en zonder overtollig acetyleen, maakte de isolatie en destillatie van zuivere aceetaldehyde mogelijk, waarbij de tijdens de reactie gegenereerde warmte werd benut.
Vergelijkbaar met het Hoechst-proces kon de katalysator worden geregenereerd met salpeterzuur. De productie van aceetaldehyde met deze methode werd echter meer dan tien jaar geleden stopgezet bij Chisso Corp.
2.3. Productie via vinylether
REPPE bij BASF introduceerde een methode met vinylether, waarbij het gebruik van giftige kwikverbindingen volledig werd vermeden. Methanol werd toegevoegd aan acetyleen bij 150-160 °C en 1600 kPa in aanwezigheid van kaliumhydroxide, wat resulteerde in de vorming van methylvinylether. De methylvinylether werd vervolgens gehydrolyseerd met verdund zuur.
2.4. Productie via ethyleendiacetaat
De toevoeging van azijnzuur aan acetyleen in aanwezigheid van kwik(II)zouten leverde ethylideendiacetaat (CH3CH(OCOCH3)2) op. Deze verbinding ontleedde bij 130-145 °C in aceetaldehyde en azijnzuuranhydride met behulp van zure katalysatoren zoals ZnCl2.
Hoewel dit proces in eerste instantie in 1914 op industriële schaal door Societe Chimique des Usines du Rhone werd ontwikkeld, heeft het de laatste tijd aan betekenis verloren.
3. Productie uit ethyleen
Ethyleen is de primaire grondstof geworden voor de productie van aceetaldehyde, waarbij het Wacker-proces de dominante methode is voor directe oxidatie van ethyleen.
3.1. Directe oxidatie van ethyleen
Het Wacker-proces, ontwikkeld door Wacker-Chemie en Hoechst tussen 1957 en 1959, omvat de volgende reactie:
CH4 + 0,5 O2 → CH3CHO (ΔH= -244 kJ/mol)
Er wordt een katalysatoroplossing gebruikt die PdCl2 en CuCl2 bevat. De reactie tussen ethyleen en waterig palladiumchloride bleek bijna kwantitatief aceetaldehyde te produceren:
C2H4 + PdCl2 + H2O → CH3CHO + Pd + 2 HCl
In het Wacker-Hoechst-proces wordt metallisch palladium opnieuw geoxideerd door CuCl2, dat vervolgens wordt geregenereerd met zuurstof:
Pd + 2 CuCl2 → PdCl2 + 2 CuCl
2 CuCl + 0,5 O2 + 2 HCl → 2 CuCl2 + H2O
Daarom is slechts een kleine hoeveelheid PdCl2 nodig voor de omzetting van ethyleen, en de snelheidsbepalende stap is de reactie van ethyleen met palladiumchloride.
Het proces kan in één of twee fasen worden uitgevoerd. Bij de eenfasemethode reageert een ethyleen-zuurstofmengsel met de katalysatoroplossing. Er ontstaat een stationaire toestand waarin de aceetaldehydevorming en de CuCl2-reductie met dezelfde snelheid plaatsvinden. De oxidatiegraad van de katalysator, uitgedrukt als de verhouding van CCu2+/(CCu2++CCu+), bepaalt deze stationaire toestand.
Bij het tweefaseproces reageren ethyleen en zuurstof afzonderlijk in verschillende reactoren en wordt de katalysatoroplossing afwisselend gereduceerd en geoxideerd. Lucht wordt doorgaans gebruikt voor de oxidatie van de katalysator in plaats van zuivere zuurstof.
3.1.1. Eenfaseproces
Bij het eenfaseproces worden ethyleen en zuurstof in een reactietoren gebracht. De katalysatoroplossing wordt gecirculeerd en gemengd met het gas met behulp van het airliftprincipe. De reactie vindt plaats bij ongeveer 130 °C en 400 kPa.
Het resulterende mengsel van aceetaldehyde, waterdamp en niet-omgezet gas wordt gescheiden, gekoeld en gewassen om de reactieproducten te scheiden.
Niet-omgezet gas wordt teruggevoerd naar de reactor, waarbij een klein deel wordt afgevoerd als uitlaatgas om ophoping van inert gas te voorkomen. Het ruwe aceetaldehyde dat wordt verkregen door het wassen, wordt vervolgens in twee fasen gedestilleerd om gezuiverd aceetaldehyde te verkrijgen.
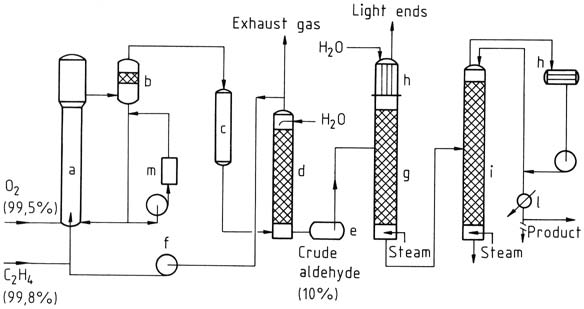
a) Reactor; b) Scheidingsvat; c) Koeler; d) Scrubber; e) Ruwe aldehydetank; f) Cyclusgascompressor; g) Destillatie van lichte eindproducten; h) Condensatoren; i) Zuiveringskolom; l) Productkoeler; m) Regeneratie
3.1.2. Twee-fasenproces
Het twee-fasenproces omvat het gebruik van buisvormige reactoren voor zowel de reactie- als oxidatiestappen. De gassen reageren bijna volledig in aanwezigheid van de katalysator. Ethyleen reageert bij lagere temperaturen en drukken, en de katalysatoroplossing die aceetaldehyde bevat, wordt vervolgens uitgebreid in een flashtoren.
Het aceetaldehyde-waterdampmengsel wordt gedestilleerd en de katalysator wordt gerecycled voor de reactie met ethyleen. Het proceswater wordt hergebruikt en een deel wordt gebruikt voor het schrobben van uitlaatlucht en gas om onzuiverheden te verwijderen. De ruwe aceetaldehyde wordt onderworpen aan twee-fasendestillatie om zuivere aceetaldehyde te verkrijgen.
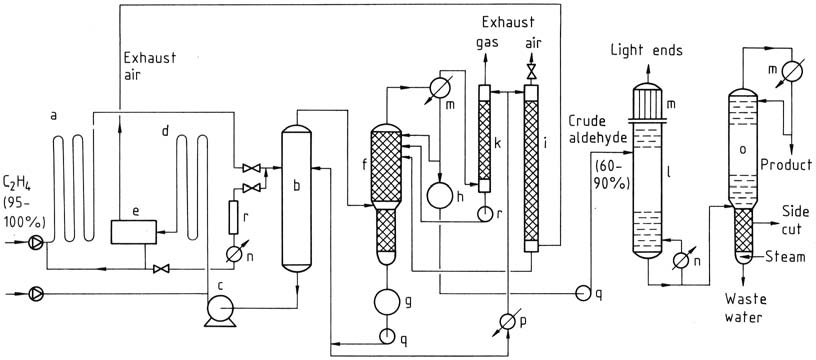
a) Reactor; b) Flash-toren; c) Katalysatorpomp; d) Oxidatiereactor; e) Afscheider voor uitlaatlucht; f) Ruwe-aldehydekolom; g) Proceswatertank; h) Ruwe-aldehydecontainer; i) Afscheider voor uitlaatlucht; k) Afscheider voor uitlaatgas; l) Destillatie van lichte eindproducten; m) Condensatoren; n) Verwarmer; o) Zuiveringskolom; p) Koeler; q) Pompen; r) Regeneratie
Zowel het een- als het twee-fase proces hebben een vergelijkbare aceetaldehyde opbrengst van ongeveer 95% en vergelijkbare productiekosten. De keuze tussen de methoden hangt af van factoren zoals de beschikbaarheid van grondstoffen, energieoverwegingen en de kosten van zuurstof.
3.2. Vorming van aceetaldehyde als bijproduct
De generatie van aceetaldehyde vindt plaats tijdens het productieproces van vinylacetaat uit ethyleen of acetyleen. Destillatie wordt gebruikt om aceetaldehyde te scheiden, dat vervolgens wordt omgezet in azijnzuur voor recyclingdoeleinden.
In een specifieke variatie van de methode, beginnend met ethyleen, worden zowel vinylacetaat als aceetaldehyde verkregen in gelijke molaire verhoudingen van 1:1. Deze eigenschap maakt het proces bijna zelfvoorzienend in termen van azijnzuurproductie.
3.3. Ethyleenoxide-isomerisatie
Voordat de directe oxidatie van ethyleen de voorkeursmethode werd, werd er uitgebreid onderzoek gedaan naar dit proces. Katalysatoren zoals Al2O3, SiO2 en zure zouten afgeleid van minerale zuren zoals zwavelzuur, fosforzuur of molybdeenzuur werden gebruikt. Hoewel opbrengsten van 90-95% zijn gerapporteerd, heeft deze aanpak geen significante industriële betekenis gekregen.
4. Productie uit C1-bronnen
Na de olieprijsstijgingen in 1973/74 en 1977, kregen C1-materialen interesse als grondstof voor organische chemicaliën en als alternatief voor petrochemicaliën. In termen van aceetaldehydeproductie lijken C1-materialen echter van beperkt belang te zijn, aangezien de meeste traditionele aceetaldehydederivaten kunnen worden gesynthetiseerd uit C1-bronnen.
4.1. Directe productie uit synthesegas
Aceetaldehyde wordt gevormd met een relatief lage selectiviteit, met een opbrengst van ongeveer 30% uit synthesegas. Het resulterende mengsel bevat ook azijnzuur, ethanol en verzadigde koolwaterstoffen, voornamelijk methaan. Katalysatoren die kobalt- en rhodiumverbindingen bevatten, geactiveerd door jodiumverbindingen of magnesiumchloride, ondersteund op een silicaatdrager, worden gebruikt. Tot op heden heeft dit proces geen industriële toepassingen gevonden.
4.2. Productie via methanol, methylacetaat of azijnzuuranhydride
De hydroformylering van methanol met behulp van CO/H2, bekend als het oxoproces, is goed ingeburgerd. Deze reactie vindt plaats in aanwezigheid van hydroformyleringskatalysatoren zoals kobalt-, nikkel- en ijzerzouten (bijv. CoBr2, CoI2) of de overeenkomstige metaalcarbonylen.
Het wordt uitgevoerd bij verhoogde temperaturen (180-200 °C) en hoge druk (30-40 MPa). Een aceetaldehydeselectiviteit van 80% of hoger is gerapporteerd bij gebruik van ijzer-kobaltcarbonyl- of kobalt-nikkelkatalysatoren in combinatie met tertiaire aminen, fosfines of nitrilen.
Op dezelfde manier is een hoge selectiviteit geclaimd voor de hydrocarbonylering van methylacetaat met palladium- of rhodiumkatalysatoren, vergezeld door tertiaire fosfines en jodiumverbindingen, of kobalt-rutheniumkatalysatoren, in aanwezigheid van methyl- en natriumjodiden.
Bepaalde patenten beschrijven de generatie van aceetaldehyde door de reductie van azijnzuuranhydride met waterstof over palladium- of platinakatalysatoren ondersteund op een drager, werkend bij lage druk en gematigde temperaturen. Als de toekomst het belang van aceetaldehyde als organisch tussenproduct vermindert, zou deze methode interessant kunnen blijken voor het economisch produceren van kleine hoeveelheden aceetaldehyde.
5. Productie uit koolwaterstoffen
Aceetaldehyde is een incidenteel bijproduct bij de productie van acroleïne, acrylzuur en propeenoxide uit propeen. Daarnaast wordt het gevormd door de oxidatie van verzadigde koolwaterstoffen (bijv. propaan of butaan) in de gasfase, zoals geïmplementeerd door Celanese in de Verenigde Staten.
Referentie
- Acetaldehyde; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_031.pub2
