Calciumcyanamide: eigenschappen, reacties, productie en toepassingen
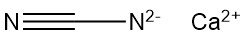
Wat is calciumcyanamide?
Calciumcyanamide, ook bekend als kalkstikstof of nitrolim, is een anorganische verbinding met de formule CaCN2. Het is een neutraal zout van cyanamide dat eind 19e eeuw voor het eerst industrieel werd geproduceerd dankzij stikstofbindende technologie.
Calciumcyanamide van industriële kwaliteit is niet zuiver CaCN2, maar bevat verschillende extra componenten. Het bestaat doorgaans uit ongeveer 20% calciumoxide en 10-12% vrije koolstof, wat het zijn karakteristieke grijszwarte uiterlijk geeft. Kleine hoeveelheden nitriden, gevormd uit silica en alumina, zijn ook aanwezig.
Het totale stikstofgehalte van commercieel calciumcyanamide varieert van 22 tot 25%, afhankelijk van de grondstoffen en productieomstandigheden. Van deze stikstof bestaat ongeveer 92-95% uit cyanamide, 0,1-0,4% uit dicyaandiamide en de rest uit metaalnitriden.
Calciumcyanamide werd voor het eerst beschreven in 1877, toen het in het laboratorium werd verkregen door calciumcarbamaat te verhitten tot roodgloeiend. In 1889 werden grotere hoeveelheden bereid door fijngemalen mengsels van ureum en calciumoxide te verhitten.
De doorbraak in commerciële productie kwam met de ontwikkeling van het Frank-Caro-proces, een methode voor de directe stikstofbehandeling van calciumcarbide, dat in 1895 in Duitsland werd gepatenteerd.
De eerste fabriek op industriële schaal voor de productie van calciumcyanamide, met behulp van een batchoven, werd in 1905 opgericht in Piano d’Orta, Italië. Rond dezelfde tijd werd de Polzeniusz-Krauss-kanaaloven geïntroduceerd, die het ontwerp en de efficiëntie van de oven verbeterde.
In 1910 waren er productiefaciliteiten gevestigd in verschillende landen, waaronder Duitsland (Bayerische Kalkstickstoffwerke; AG für Stickstoffdünger), Frankrijk, Japan, Zweden, Zwitserland en de Verenigde Staten (American Cyanamid).
Inhoudsopgave
- Wat is calciumcyanamide?
- 1. Fysische eigenschappen van calciumcyanamide
- 2. Chemische reacties van calciumcyanamide
- 3. Industriële productie van calciumcyanamide
- 4. Toepassingen van calciumcyanamide
- Referenties
1. Fysische eigenschappen van calciumcyanamide
Zuiver calciumcyanamide is een hygroscopische, kleurloze vaste stof die kristalliseert in het rhombohedrale systeem. Het smelt bij verhitting in een stikstofatmosfeer tot ongeveer 1300 °C.
Belangrijke fysische eigenschappen van calciumcyanamide zijn opgenomen in tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | 156-62-7 |
| Chemische formule | CaCN2 |
| Molaire massa | 80,10 g·mol-1 |
| Uiterlijk | Kleurloze, hygroscopische kristallen |
| Kristalsysteem | Romboëdrisch |
| Dichtheid (25 °C) | 2,36 g·cm-3 |
| Smeltpunt (in N2) | ~1300 °C (met ontleding) |
| Smeltwarmte | 54 kJ·kg-1 |
| Soortelijke warmte (20–100 °C) | 909 J·kg-1·K-1 |
| Standaard vormingsenthalpie (ΔH°298) | –348 kJ·mol-1 |
| Standaard Gibbs vrije vormingsenergie (ΔG°298) | –303 kJ·mol-1 |
| Standaard molaire entropie (S°298) | 87,1 J·mol-1·K-1 |
2. Chemische reacties van calciumcyanamide
Het chemische gedrag van calciumcyanamide varieert afhankelijk van de temperatuur, de gasatmosfeer en de aanwezige onzuiverheden.
Thermische ontleding:
Boven 1000 °C ontleedt calciumcyanamide, en de producten zijn afhankelijk van de omstandigheden. Bij verhitting in vacuüm of in een inerte atmosfeer zijn de belangrijkste producten calciumcarbide, metallisch calcium en stikstofgas:
2 CaCN2 → CaC2 + Ca + 2 N2
Bij verhoogde stikstofdruk bevordert de ontleding de vorming van cyanideverbindingen, terwijl calciumnitride en elementair koolstof meestal als bijproducten aanwezig zijn.
Oxidatiereacties:
Calciumcyanamide reageert met zuurstof en koolstofdioxide vanaf ongeveer 475 °C tot stikstofgas en calciumcarbonaat. Bij hogere temperaturen (boven 850-900 °C) wordt calciumoxide het hoofdproduct. Koolstof, aanwezig als verontreiniging, wordt niet verwijderd door oxidatie, omdat de reactie bij voorkeur calciumcyanamide verbruikt.
Reactie met koolmonoxide:
Bij temperaturen boven 1000 °C reageert koolmonoxide met calciumcyanamide tot calciumcarbide en calciumoxide.
Reacties in waterige media:
In water hangt de reactiviteit van calciumcyanamide sterk af van temperatuur en pH:
- Bij kamertemperatuur vormt het monocalciumcyanamide Ca(HCN2)2.
- Bij verhitting tot pH 9–10 wordt het omgezet in calciumhydroxide en dicyaandiamide [(NH2)2CNCN].
- Bij pH 6–8 en lager dan 40 °C ontstaat cyanamide, terwijl kalk neerslaat bij toevoeging van koolstofdioxide.
- In zure oplossing met geschikte katalysatoren kan ureum worden gevormd; In aanwezigheid van sulfiden wordt thioureum verkregen.
Hydrolyse tot ammoniak:
Onder alkalische omstandigheden bij ongeveer 200 °C en verhoogde druk hydrolyseert calciumcyanamide tot ammoniak en calciumcarbonaat:
CaCN2 + 3 H2O → CaCO3 + 2 NH3
Deze hydrolysereactie werd begin 20e eeuw historisch gebruikt als industriële methode voor ammoniakproductie, vóór de wijdverbreide toepassing van het Haber-Bosch-proces.
3. Industriële productie van calciumcyanamide
Calciumcyanamide wordt geproduceerd door stikstofvorming van calciumcarbide, een proces met drie fasen.
1. Kalkproductie: Kalksteen met een hoge zuiverheidsgraad wordt gecalcineerd tot ongebluste kalk:
CaCO3 → CaO + CO2
2. Calciumcarbidesynthese: Ongebluste kalk reageert met cokes of steenkool in een elektrische weerstandsoven tot calciumcarbide. Het proces vereist het smelten van de kalk en de opname van de endotherme reactiewarmte:
CaO + 3 °C → CaC2 + CO
3. Nitrogenering van calciumcarbide: Calciumcarbide reageert met stikstof bij 900–1000 °C tot calciumcyanamide en koolstof:
CaC2 + N2 → CaCN2 + C
Deze reactie is exotherm. Eenmaal gestart, wordt deze voortgezet door gecontroleerde stikstoftoevoeging zonder verdere externe verhitting. De warmteafgifte bedraagt 286,6 kJ·mol⁻¹ bij 1100 °C en 295 kJ·mol⁻¹ bij 0 °C.
Reactiemechanisme
Bij de vorming van calciumcyanamide zijn tussenproducten betrokken zoals Ca(CN)2, CaC2N2, CaC en Ca2N2. De belangrijkste producten van de stikstofvorming zijn calciumcyanamide en koolstof. Bij temperaturen boven 1000 °C vormt zich calciumcyanide in evenwicht met cyanamide en koolstof:
CaCN2 + C ⇌ Ca(CN)2 ; ΔH298= +163 kJ/mol
Dit evenwicht is endotherm, in tegenstelling tot de exotherme stikstofvormingsreactie. Boven 1160 °C smelt het CaCN2–C–Ca(CN)2-systeem met meer dan 60% cyanamide bij evenwicht.
Kleine cyanidefracties die bij 1000–1100 °C ontstaan, worden door langzame afkoeling weer omgezet in cyanamide. Snelle afkoeling bevordert de retentie van cyanide, wat de basis vormde voor het historische fusiecyanideproces voor de productie van natriumcyanide.
Bijproducten van stikstofvorming
Onzuiverheden in technisch calciumcarbide verlagen de opbrengst van calciumcyanamide. Silica en aluminiumoxide in de grondstof reageren met CaCN2 om nitriden te vormen:
3 CaCN2 + Al2O3 → 3 CaO + 2 AlN + 3 C + 2 N2
3 CaCN2 + SiO2 → 2 CaO + CaSiN2 + 3 C + 2 N2
Carbidverontreinigingen zoals calciumhydroxide en calciumcarbonaat ontbinden tijdens verhitting tot water en koolstofdioxide. Deze reageren met carbide om acetyleen te vormen. De ontleding van acetyleen genereert waterstof, dat consistent wordt aangetroffen in de uitlaatgassen van stikstofovens.
Onbedoeld ingebrachte zuurstof tijdens de stikstofbehandeling verlaagt de opbrengst verder. Het totale efficiëntieverlies tijdens het proces bedraagt ongeveer 10%. Hoogzuivere grondstoffen leveren de beste resultaten op.
Katalysatoren en kinetiek
Fluxen zoals calciumchloride en calciumfluoride worden gebruikt om de reactiesnelheid te verhogen of de stikstofbehandelingstemperatuur te verlagen. Hun exacte rol is niet volledig bekend, maar men denkt dat ze een tijdelijke vloeistoffase creëren, consistent met het gesinterde uiterlijk van het eindproduct.
Studies tonen aan dat calciumfluoride de reactiesnelheid met een factor 4,5 verhoogt bij 1000 °C en de optimale temperatuur verlaagt.
De stikstofbehandelingssnelheid is afhankelijk van de temperatuur, de partiële stikstofdruk, de zuiverheid van het carbide, de additieven en de kristallietgrootte. Grofkorrelig, hoogzuiver carbide reageert langzamer dan lamellair gestructureerd carbide. Metaalhalogeniden versnellen de stikstofbehandeling.
Het reactiefront beweegt zich vanaf het oppervlak van de carbidekorrels naar binnen. Bij lage temperaturen bepaalt stikstofdiffusie door de poreuze productlaag de snelheid, terwijl bij hogere temperaturen of in aanwezigheid van additieven de chemische oppervlaktereactie snelheidsbeperkend is.
3.1. Industriële processen
Zowel batch- als continue methoden zijn gebruikt voor de industriële bereiding van calciumcyanamide. De belangrijkste processen zijn het Frank-Caro batchovenproces en het Trostberg-rotatieovenproces, waarbij de exotherme reactie van calciumcarbide met stikstof plaatsvindt bij 1000-1150 °C.
Bij het rotatieovenproces houdt de reactiewarmte de werking na de initiatie in stand, terwijl bij de batchmethode voor elke lading een ontsteking nodig is.
3.1.1. Frank-Caro batchovenproces
Het batchovenproces domineerde de productie gedurende de eerste helft van de 20e eeuw, maar heeft sindsdien aan belang ingeboet vanwege de lage stikstofopbrengsten, de hoge arbeidsbehoefte en de beperkte doorvoer.
Bij deze methode worden reactoren gevuld met maximaal 10 ton gemalen calciumcarbide. De reactie wordt geïnitieerd door elektrische verhitting of een pyrotechnisch mengsel, waarna stikstofgas via inlaten in de ovenmantel wordt ingebracht.
De stikstofvorming verloopt spontaan en duurt enkele dagen. Het resultaat is een vast gesinterd blok calciumcyanamide, dat vervolgens wordt gebroken en vermalen tot een bruikbaar product.
3.1.2. Trostberg-draaiovenproces
Het continue draaiovenproces is ontwikkeld door SKW Trostberg (nu Degussa AG). De oven is ongeveer 20 m lang en bekleed met vuurvaste klei. De verbrede ovenkop dient als de belangrijkste reactiezone.
Gemalen calciumcarbide (55-60% CaC2-gehalte) wordt gemengd met calciumfluoride en gerecyclede kalkstikstof, waarna stikstofgas wordt toegevoegd. De vaste stoffen blijven 5-6 uur in de oven en de exotherme reactiewarmte houdt de bedrijfstemperatuur op 1000-1100 °C.
Na het opstarten kan de oven vele maanden zonder externe verwarming draaien. De output is een korrelige of poedervormige kalkstikstof die naar een koeltrommel wordt overgebracht. Een enkele unit heeft een capaciteit van ongeveer 25 ton gebonden stikstof per dag.
3.1.3. Alternatieve processen
Er zijn alternatieve routes onderzocht om het hoge energieverbruik van conventionele methoden te verminderen, met name bij de productie van calciumcarbide. Tussen 600 en 1000 °C reageert kalk met stikstofhoudende verbindingen om calciumcyaanamide te vormen. Voorbeelden hiervan zijn reacties met blauwzuur, dicyaan, ureum en dicyaandiamide.
- Kalk en ureum vormen aanvankelijk calciumcyanaat, dat bij verhitting wordt omgezet in calciumcyanuraat en uiteindelijk in calciumcyanamide.
- Kalk reageert met waterstofcyanide bij 750-850 °C tot calciumcyanamide.
- Kalk reageert met ammoniak en koolmonoxide bij 700-900 °C tot 99% calciumcyanamide.
Deze processen leveren witte calciumcyanamide op, vrij van de koolstofhoudende onzuiverheden die gepaard gaan met de conventionele route op basis van kalksteen en steenkool. Geen van deze methoden heeft echter grootschalige commercialisering bereikt vanwege economische of opbrengstbeperkingen.
3.2. Verwerking van technisch calciumcyanamide
Ruw calciumcyanamide wordt gemalen in buismolens totdat het materiaal door een zeef van 0,2 mm gaat. Voor commerciële producten die in korrelvorm worden geleverd, wordt de maalstap overgeslagen en wordt de gewenste deeltjesgrootte verkregen door middel van zeven.
Wanneer het restgehalte calciumcarbide meer dan 0,1% bedraagt, zoals gebruikelijk is in producten uit het Frank-Caro-proces, ondergaat het materiaal een ontgassingsbehandeling met water. In deze stap reageert het carbide tot acetyleen en calciumhydroxide.
Om aan de milieu- en veiligheidsvoorschriften te voldoen, moeten de acetyleenrijke afgassen worden verbrand en vervolgens worden gereinigd om zure bijproducten te verwijderen.
Granulatie
De verwerking van fijn verdeelde calciumcyanamide als meststof brengt aanzienlijke stofgerelateerde uitdagingen met zich mee. Om deze problemen te beperken, kan het materiaal worden behandeld met olie of worden omgezet in een dichter product door middel van granulatie of verdichting.
Granulatie met calciumnitraatoplossingen produceert uniforme, korrelachtige calciumcyanamidekorrels. Deze korrels zorgen voor een dubbel stikstofsysteem, waarbij nitraatstikstof, die direct beschikbaar is voor planten, wordt gecombineerd met cyanamidestikstof, die langzamer vrijkomt.
Het is stabiel tijdens opslag omdat het vrije calciumoxide volledig gehydrateerd is, waardoor volumetrische uitzetting wordt voorkomen.
In Europa is Degussa AG de belangrijkste fabrikant van calciumcyanamidekorrels in korrelvorm.
4. Toepassingen van calciumcyanamide
Calciumcyanamide wordt veel gebruikt in de land- en tuinbouw, met name in Europa en Azië, als een langzaam werkende stikstofmeststof. Naast het leveren van stikstof biedt het bijkomende voordelen door het onderdrukken van bodempathogenen, slakken en opkomende onkruiden.
Bij contact met bodemvocht ontleedt het tot kalk en vrije cyanamide. De cyanamidefractie is verantwoordelijk voor fungicide en herbicide effecten. Micro-organismen in de bodem zetten cyanamide vervolgens om in ureum en vervolgens in ammoniak.
Een alternatieve omzettingsroute leidt tot de vorming van dicyaandiamide, een bekende nitrificatieremmer. Door de oxidatie van ammonium tot nitraat te vertragen, vermindert dit proces de uitspoeling van nitraat en verlengt het de stikstofbeschikbaarheid met enkele weken.
Dit maakt calciumcyanamide bijzonder voordelig voor intensief bewerkte bodems met een hoge pathogenenbelasting die wortel- en stengelrot veroorzaakt.
Recente innovaties in ureummeststoffen omvatten de toevoeging van een calciumcyanamidekern in ureumkorrels. Dit ontwerp stabiliseert de stikstoffractie door de nitrificatie te vertragen.
Naast gewasbemesting kent calciumcyanamide toepassingen in diergezondheidszorg. Wanneer het op weilanden wordt verspreid, bestrijdt het de dwergwaterslak (de tussengastheer van leverbot) en vernietigt het de eieren en larven van darm- en maagparasieten in grassen. Het onderdrukt ook salmonella in vloeibare mest.
In industriële en milieucontexten verwijdert calciumcyanamide effectief stikstofoxiden uit uitlaatgassen, met een rendement van meer dan 99% bij gebruik in wasprocessen. In de cementindustrie verbetert de toevoeging van cyanamide en calciumcyanamide het verhardingsgedrag, verbetert de druksterkte en vermindert het de vries-dooi-verslechtering.
Calciumcyanamide van farmaceutische kwaliteit wordt gebruikt bij de behandeling van chronisch alcoholisme. In kleine dagelijkse doses veroorzaakt het bijwerkingen, zoals blozen, bij alcoholgebruik, waardoor alcoholgebruik wordt ontmoedigd.
In de metallurgie wordt calciumcyanamide gebruikt als stikstofdonor bij het nitreren van staal en als ontzwavelingsmiddel. Bovendien vormt het een belangrijke grondstof voor de chemische industrie bij de synthese van cyanamide, dicyaandiamide en thioureum.
Referenties
1. Güthner, T. and Mertschenk, B. (2006). Cyanamides. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a08_139.pub2
2. Cameron, W. (2010). Cyanamides. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0325011416012005.a01.pub3
3. Klimek, A.; Yount, J.; Wozniak, D.; Zeller, M.; Piercey, D. G. “A Laboratory Preparation of High-Purity Calcium Cyanamide.” Inorg. Chem., 2023, 62 (40), 16280–16282. DOI: 10.1021/acs.inorgchem.3c02235
4. Dedman, A. J.; Owen, A. J. “Calcium cyanamide synthesis. Part 3.—The decomposition of ammonia and the mechanism of cyanamide ion formation.” Trans. Faraday Soc., 1961, 57, 684–693. DOI: 10.1039/TF9615700684
