Calciumcarbide: eigenschappen, productie en toepassingen

Wat is calciumcarbide?
Calciumcarbide, ook bekend als calciumacetylide, is een grijszwarte, kristallijne verbinding met de chemische formule CaC2. Bij contact met water genereert het acetyleen, een zeer ontvlambaar gas dat ooit veel werd gebruikt voor verlichting en lassen.
Van de carbiden is calciumcarbide het meest industrieel significant. Het blijft de ruggengraat van de acetyleenlasgasindustrie, met name in regio’s waar grondstoffen en energie gemakkelijk verkrijgbaar zijn en aardolie schaars is.
Inhoudsopgave
Calciumcarbide wordt in veel landen geproduceerd als voorloper voor verschillende op acetyleen gebaseerde producten, met name polyvinylchloride (PVC) en bij de productie van calciumcyanamide.
Het wordt ook gebruikt bij het ontzwavelen van gesmolten metalen zoals ijzer en staal, en in gieterijpraktijken, waar het deel uitmaakt van metaalbehandelingsadditieven.
De chemische samenstelling van calciumcarbide werd voor het eerst geïdentificeerd door Wöhler in 1862, verkregen door de reactie van een calcium-zinklegering en steenkool. Voordien hadden verschillende onderzoekers de verbinding in laboratoria voorbereid, vaak met behulp van elektrische bogen op steenkool of cokesproducten in de aanwezigheid van calciumverbindingen.
Eind 19e eeuw was er de ontwikkeling van industriële productie in elektrothermische ovens. Moissan in Frankrijk en Morehead en Willson in de Verenigde Staten legden onafhankelijk van elkaar de basis voor deze technologische sprong tussen 1885 en 1895. De eerste operationele industriële carbideoven, gebouwd door de Willson Aluminium Company in Spray, VS, verscheen in 1895.
Bertolus stelde in 1897 het gebruik van meerfasen elektrische stromen voor industriële ovens voor. Helfenstein volgde in 1904 met een driefasenstroomoven uitgerust met drie elektroden. Deze vroege ovens, met een capaciteit van 3000 tot 7500 kW, bevatten zelfs systemen voor het terugwinnen van afvalgas (Helfenstein-barrière). Binnen een eeuw werden ovens van 40 MW gebruikelijk.
Moderne grote elektrische ovens, die tot 60 MW aankunnen, gebruiken Soderberg-elektroden en zijn volledig omsloten, waardoor koolmonoxide-bijproducten kunnen worden teruggewonnen. Recente ontwikkelingen hebben zich gericht op de ontwikkeling van betrouwbare, middelgrote gesloten ovens die beter aansluiten op de vraag van de markt en de beschikbare grondstoffen.
Het carbothermische proces, dat tussen 1940 en 1960 door BASF in Duitsland werd gebruikt, bood een alternatieve route naar de productie van calciumcarbide, maar is sindsdien verlaten.
1. Fysische eigenschappen van calciumcarbide
Calciumcarbide, CaC2, is een binaire ionische verbinding met een molaire massa van 64,10 g/mol. In zijn zuivere vorm is het kleurloos en geurloos. Technisch materiaal vertoont echter vaak verschillende tinten grijs tot bruinzwart, soms met violette of roodbruine tinten, vanwege onzuiverheden.
De karakteristieke fosfinegeur van technisch calciumcarbide komt voort uit sporen calciumfosfide die reageren met vocht.
Zuiver calciumcarbide heeft een hoog smeltpunt van 2160 °C en ontbindt volledig boven 2500 °C. Er bestaan vier verschillende kristallografische modificaties:
- Fase I: tetragonaal, stabiel tussen 25 en 440 °C (dominant in commercieel carbide)
- Fase II en III: lagere symmetrie, stabiel onder 440 °C
- Fase IV: vlakgecentreerd kubisch, stabiel boven 440 °C
De transformatiewarmte bij 440 °C is 8,68 J/g. Opvallend is dat het CaC2-CaO-fasediagram een eenvoudig eutectisch gedrag vertoont, zonder verbindingsvorming of vaste oplossingen in de vaste toestand. De componenten worden pas volledig mengbaar boven de liquiduslijn. Onzuiverheden in technisch-kwaliteit carbide verlagen de liquidustemperatuur.
Calciumcarbide heeft een gemiddelde specifieke warmtecapaciteit van 1047 J kg⁻¹ K⁻¹ tussen 20 en 440 °C en een smeltwarmte van 1470 J/g voor zuiver materiaal. De standaardenthalpie van de vorming van elementen bij 298 K is -59,4 kJ/mol en de standaardentropie is 70,3 J mol⁻¹ K⁻¹.
De elektrische geleidbaarheid van calciumcarbide varieert van 100 tot 1000 S.m⁻¹ en is sterk afhankelijk van de zuiverheid en temperatuur.
2. Chemische eigenschappen van calciumcarbide
Calciumcarbide, CaC2, ondergaat een reeks belangrijke chemische reacties:
Synthese van calciumcyaanamide: Deze exotherme reactie (ΔH298 = -289 kJ/mol) zet calciumcarbide en stikstofgas om in calciumcyaanamide en koolstof: CaC2 + N2 → CaCN2 + C.
Hydrolyse tot acetyleen: Reactie met water produceert gemakkelijk acetyleen, calciumhydroxide en warmte (ΔH298 = -128,4 kJ/mol): CaC2 + 2 H2O → C2H2 + Ca(OH)2.
Efficiënte acetyleenproductie vindt plaats onder de 300 °C, waarbij zuiver calciumcarbide 346,89 l/kg (droog) oplevert bij 0 °C en 101,3 kPa (iets hoger bij 15 °C met aanwezige waterdamp). Hoge temperaturen leveren in plaats daarvan calciumoxide, waterstof en koolstofdioxide op.
Reactie met zwavel: Calciumcarbide reageert met zwavel in gesmolten ijzer om calciumsulfide te vormen en koolstof vrij te geven: CaC2 + [S]Fe → CaS + 2 [C]Fe.
Hydrogenering: Onder druk produceert hydrogenering van calciumcarbide niet alleen calciumhydride en methaan, maar ook andere koolwaterstoffen.
Calciumcarbide lost op in verschillende gesmolten zouten, waardoor verschillende reductiereacties mogelijk zijn.
Elektrolyse: Elektrolyse van opgelost calciumcarbide in gesmolten zouten levert calcium op bij de kathode en koolstof bij de anode.
3. Productie van calciumcarbide
Hoewel de bereiding van zuiver calciumcarbide academisch interessant is, geeft de industriële productie prioriteit aan technisch materiaal voor praktische toepassingen. Dit is grotendeels afhankelijk van de reactie bij hoge temperatuur van ongebluste kalk (CaO) met koolstofhoudende bronnen zoals cokes en antraciet:
CaO + 3 C → CaC2 + CO (ΔH298 = +465 kJ/mol)
De reactiesnelheid wordt pas significant boven 1600 °C. Echter, boven de 2000 °C treden ongewenste nevenreacties op, met name:
CaC2 → Ca + 2 C
CaC2 + 2 CaO → 3 Ca + 2 CO
Daarom werken industriële processen binnen het bereik van 1800-2100 °C, wat technisch calciumcarbide oplevert met een CaC2-gehalte van ongeveer 80%. De rest bestaat voornamelijk uit CaO, met extra onzuiverheden zoals SiO2 en Al2O3 uit grondstoffen.
Hoge temperaturen zijn cruciaal voor de productie van calciumcarbide, waarvoor twee mogelijke benaderingen nodig zijn:
- Elektrothermische schachtoven: Smelt het koolstofhoudende materiaal met CaO in een korte oven, waarbij direct elektrische energie wordt geïntroduceerd.
- Zuurstofverbrandingsschachtoven: Verbrandt koolstofhoudend materiaal met zuivere of verrijkte zuurstof in aanwezigheid van CaO.
Hoewel de laatste methode synthesegas als bijproduct bood, werd deze uiteindelijk na 50 jaar verlaten vanwege de goedkopere productie van hetzelfde gas uit aardolie. Tegenwoordig gebruikt alle commerciële calciumcarbideproductie de eerste elektrothermische benadering.
3.1. Grondstoffen
De grondstoffen voor de productie van calciumcarbide, bekend als de “last” in de elektrothermische oven, spelen een cruciale rol in efficiëntie en productkwaliteit. Deze materialen bestaan uit twee hoofdcomponenten: een koolstofbron en een kalkhoudende component.
Deeltjesgrootte, sterkte en geleidbaarheid hebben een aanzienlijke invloed op de prestaties en operationele stabiliteit van de oven. Kleinere open ovens bieden flexibiliteit bij het handmatig of mechanisch aanpassen van deze eigenschappen, terwijl gesloten ovens met een hoge capaciteit strengere specificaties vereisen voor onbeheerde werking.
Vluchtige stoffen en asgehalte beïnvloeden de reactie-efficiëntie en afvalgeneratie. Moderne gesloten ovens laten fijnkorrelige materialen toe door ze rechtstreeks door holle elektroden te injecteren. Onzuiverheden zoals metaaloxiden kunnen ongewenste nevenreacties veroorzaken en vereisen zorgvuldig beheer.
Koolstofbron
- Cokes: Cokes, afgeleid van bitumineuze steenkool of bruinkool, is het belangrijkste koolstofhoudende materiaal dat wereldwijd wordt gebruikt vanwege de beschikbaarheid en geschikte eigenschappen. Korrelgrootte varieert doorgaans van 3-25 mm, met fijnere fracties die via elektroden worden geïnjecteerd. Het vochtgehalte moet lager zijn dan 2% en het asgehalte lager dan 15% voor een optimale productie.
- Andere opties: Ongecalcineerde antraciet en petroleumcokes kunnen gedeeltelijk worden gebruikt in gesloten ovens, maar vereisen calcinatie om de vluchtige stoffen tot onder de 2% te reduceren voor exclusief gebruik. Houtskool vindt alleen toepassing in kleine open ovens.
Kalkhoudende component
- Ongebluste kalk: De overheersende keuze, waarbij grote gesloten ovens een korrelgrootte van 6-50 mm en injectie van fijnere fracties vereisen. Het magnesiumgehalte moet lager zijn dan 2% voor een efficiënte werking. Kalk moet zacht maar duurzaam zijn, haalbaar via moderne ovens, en een CO2-gehalte hebben van minder dan 2%.
- Gerecycled calciumhydroxide: Dit bijproduct van de acetyleenproductie kan worden gebruikt als een goedkope grondstof na granulatie of briketteren, maar de opbouw van onzuiverheden beperkt het recyclingpotentieel.
Afvalplastic wordt steeds meer onderzocht als een secundaire koolstofbron, met strikte specificaties voor het chloorgehalte (max. 12%) vanwege de ongewenste verdamping en reactie met calcium.
Tabellen 1 en 2 geven voorbeelden van typische grondstofsamenstellingen voor de productie van calciumcarbide.
| Materiaal | Vast koolstof | Vluchtig koolstof | Vocht | Zwavel | As |
|---|---|---|---|---|---|
| Metallurgische cokes | 89,0 | 0,8 | 0,8 | 0,8 | 9,4 |
| Antraciet | 80,0 | 6,0 | 8,0 | 0,8 | 6,0 |
| Petroleumcokes | 81,6 | 9,0 | 8,0 | 1,9 | 0,3 |
| Component | Nieuwe kalk | Gerecycleerde kalk |
|---|---|---|
| Totaal CaO | 93,8 | 89,0 |
| Vrij CaO | 93,6 | - |
| CaSO4 | 0,4 | - |
| SiO2 | 1,3 | 2,9 |
| Fe2O3 | 0,4 | 0,4 |
| Al2O3 | 0,5 | 2,4 |
| MgO | 0,8 | 0,8 |
| CO2 | 2,7 | 3,0 |
| P2O5 | 0,015 | 0,01 |
| Verlies bij ontsteking (CO2) | 0,5 | 0,5 |
3.2. Elektrothermische reductie
Het ruwe materiaalmengsel voor de productie van calciumcarbide ondergaat een hogetemperatuurverwerking in een elektrische oven met korte schacht. Onderzoeken suggereren een reactiemechanisme in twee stappen:
- Calcinatie: CaO + C → Ca + CO
- Carbidevorming: Ca + 2 C → CaC2
De primaire reactiezone in de oven ligt in een gesmolten CaC2-CaO-fase. De complexe wisselwerking tussen elektrische stroom, warmtetoevoer, temperatuur en chemische reacties wordt echter nog steeds niet volledig begrepen.
De snelheidsbeperkende stap omvat waarschijnlijk het transporteren van opgelost CaO in de smelt naar het oppervlak van de cokeskorrel, waar CaC2-vorming plaatsvindt. Deze nieuw gevormde CaC2 lost gemakkelijk weer op in de smelt.
Ten slotte wordt het gesmolten calciumcarbide uit de ovenbodem afgetapt.
3.3. Ovens
Calciumcarbide ovens kunnen worden gecategoriseerd op basis van drie belangrijke aspecten:
- Elektrische voeding: Eenfase of driefase.
- Elektrode-opstelling: Seriële, symmetrische of andere configuraties.
- Luchtuitsluiting: Open, half bedekt of gesloten.
1. Enkelfasige ovens
Deze ovens zijn ontwikkeld in 1928 en werken op hoge stroom en lage spanning, waarbij vermogensfactoren tot 0,95 worden bereikt. Ze zijn echter minder efficiënt en zijn uit de gratie geraakt vergeleken met driefasige ontwerpen.
2. Driefasenovens
Het dominante type vandaag de dag, gecategoriseerd op elektrode-indeling:
- Serieel: Biedt voordelen bij het voeden en distribueren, maar beperkingen bij het terugwinnen van gas en het stroomverbruik.
- Symmetrisch: Hoogwaardig ontwerp met gebalanceerde vermogensfactoren en overlappende gesmolten zones bij hoger vermogen.
3. Half-overdekte ovens
Vroege ovens ventileerden CO rechtstreeks, wat vervuiling veroorzaakte. Moderne ontwerpen maken gebruik van gasafzuigkappen, hoewel gesloten ovens de beste milieubeheersing bieden.
4. Gesloten ovens
Deze moderne ovens bieden 100% gasterugwinning en minimale impact op het milieu. Belangrijke onderdelen zijn:
- Haard: Gemaakt van staal en vuurvaste materialen om hoge temperaturen te weerstaan.
- Elektroden: Soderberg-elektroden hebben de voorkeur vanwege hun kosteneffectiviteit en continue werking. Holle elektroden maken directe injectie van grondstoffen mogelijk.
- Stroomvoorziening: Transformatoren met oliekoeling en regelbare output om schommelingen te beheersen.
- Stroomdiagram: vertegenwoordigt de complexe wisselwerking van weerstanden en reactanties in de oven.
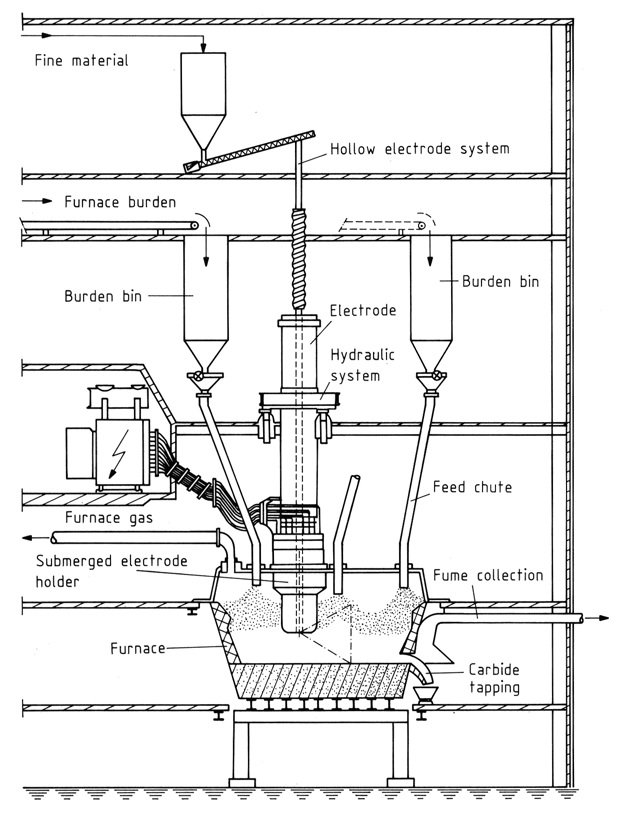
Driefase ovens vereisen impedantiecontrole door de diepte van de elektrode-onderdompeling aan te passen om het vermogen en de ovenweerstand te beheren. Gesloten kappen kunnen manipulatie van toevoergoten mogelijk maken om de weerstand verder te regelen.
3.4. Industrieel proces
De productie van calciumcarbide begint met een fundering van grove cokes die in de oven is gelaagd. Elektroden worden nauwkeurig naar de cokes verlaagd totdat elektrische bogen contact signaleren. Naarmate de cokes rode hitte bereikt, wordt de ovenbodem geleidelijk gevoed met last en wordt het vermogen stapsgewijs verhoogd om de stijgende temperatuur te evenaren.
Consistente lastvoeding is essentieel voor een optimale werking van de oven. Kleine samenstellingsvariaties kunnen worden beperkt door toevoeging van kalk, wat diepere elektrode-onderdompeling vereist vanwege de lagere geleidbaarheid van kalk.
Een te hoge elektrodehoogte riskeert carbidevorming in de bovenste lastlagen, wat mogelijk leidt tot gevaarlijke smelt “spatting”. Het handhaven van gaspermeabiliteit binnen het vaste materiaal is essentieel voor consistente productie.
De druk in de ovenkap moet nauwkeurig in evenwicht zijn met de atmosferische druk om zuurstofintrusie of lekkage van koolmonoxide te voorkomen. Grote ovenopstellingen maken vaak gebruik van gecentraliseerde controlekamers voor efficiënte werking en uitgebreide bewaking van omgevingsparameters.
Tappen omvat het mechanisch openen van de oven of het gebruiken van een elektrische boog om een tapgat te creëren. Een speciale gebakken elektrode vergemakkelijkt het smelten van carbide, dat stroomt bij temperaturen variërend van 1700-2100 °C, afhankelijk van de zuiverheid, in speciaal ontworpen gekoelde gietijzeren gietlepels.
Vanwege het hoge smeltpunt en snelle warmteverlies stolt technisch-kwaliteit carbide (80% CaC2) snel, waardoor continu onderhoud van het tapgat met stalen staven noodzakelijk is.
Kettinggordijnen, gaas en stalen afschermingen beschermen operators tegen hete gassen, stof en potentieel gevaarlijk spuitend carbide tijdens het tapproces. Gespecialiseerde beschermende uitrusting, waaronder aluminium bedekte brandwerende jassen, donkere brillen en beschermende vizieren, is verplicht voor alle personeelsleden die betrokken zijn bij tapwerkzaamheden.
Rookafzuigsystemen verwijderen schadelijke aerosoldeeltjes effectief, waardoor de impact op het milieu wordt verminderd.
Moderne hydraulische manipulatoren die zijn uitgerust met verwisselbare gereedschappen hebben tapprocedures gerevolutioneerd, waardoor de noodzaak voor directe menselijke betrokkenheid wordt geminimaliseerd en de veiligheid wordt verbeterd.
De reductie van onzuiverheden zoals Fe2O3 en SiO2 door koolstof levert ferrosilicium op, dat vanwege de hogere dichtheid onder de carbidesmelt bezinkt en doorgaans wegstroomt tijdens het tappen. Het lagere smeltpunt ten opzichte van carbide vereist echter constante waakzaamheid en preventieve maatregelen om lekkage door scheuren in de ovenvoering te voorkomen.
4. Toepassingen van calciumcarbide
Calciumcarbide wordt gebruikt bij de productie van acetyleen, de reactie met stikstof om calciumcyaanamide te vormen en de ontzwaveling van hete metalen.
Hoewel het gebruik ervan als voorloper voor zware chemicaliën is afgenomen vanwege de dominantie van petrochemicaliën sinds de jaren 60, blijft acetyleen afgeleid van calciumcarbide belangrijk bij gaslassen. De aanpasbaarheid en draagbaarheid maken het onmisbaar voor taken zoals pijpleidingconstructie, zelfs te midden van de vooruitgang in materiaalverbindingstechnieken.
Acetyleen blijft nichetoepassingen vinden in de synthese van specifieke chemicaliën, zoals butyndiol voor kunststoffen en vezels, en acetyleenzwart voor droge batterijen.
De reactiviteit van calciumcarbide met zwavel maakt het een waardevol hulpmiddel in de metallurgie. Strikte staalkwaliteitsnormen vereisen een minimaal zwavelgehalte en ontzwaveling met calciumcarbide vóór de staalproductieconverter blijkt de meest economische methode.
Injectie van fijngemalen (< 100 mm) calciumcarbide in het gesmolten metaal verlaagt effectief het zwavelgehalte, doorgaans van 0,2% tot zo laag als 0,001%. Combinaties van calciumcarbide met magnesium worden steeds vaker onderzocht om de reactiviteit in het hete metaal te verbeteren.
In gieterijpraktijken wordt grofkorrelig calciumcarbide, vaak gecombineerd met additieven zoals vloeispaat, gebruikt bij ontzwaveling. Het mengsel wordt na het tikken en vóór het gieten in de gietlepel geroerd, wat bijdraagt aan een verbeterde metaalkwaliteit.
5. Toxicologie van calciumcarbide
Calciumcarbide wordt geclassificeerd als een ernstige oogirritant en een huidirritant, met een laag potentieel voor sensibilisatie.
Calciumcarbide van commerciële kwaliteit kan acute inhalatieschade opleveren vanwege de corrosieve/irriterende eigenschappen.
Er zijn beperkte gegevens beschikbaar voor calciumcarbide zelf, maar er worden zorgen geuit over bepaalde sporencomponenten:
- Fosfine: Genotoxisch bewijs bestaat, maar de lage concentratie in calciumcarbide (< 0,1%) minimaliseert het risico.
- Arseen: Hoewel aanwezig in < 0,1%, kan dit potentiële carcinogeen arsine genereren bij contact met water. De huidige CLP-criteria vereisen echter geen classificatie als carcinogeen.
Gebaseerd op de lage niveaus van arseen en de beperkte omzetting ervan in arsine, is classificatie als carcinogeen niet gerechtvaardigd.
Vanwege de snelle afbraak in water is de ecotoxiciteit van de zuivere verbinding verwaarloosbaar.
Studies op vissen, watervlooien en algen bieden inzicht in de toxiciteit van afbraakproducten en kleine bestanddelen.
De hoge LC50 voor vissen (>50 mg/L) en EC50 voor Daphnia (4,42 mg/L) weerspiegelen waarschijnlijk de toxiciteit van waterstofsulfide, geproduceerd uit de onzuiverheid calciumsulfide.
Over het algemeen suggereren biodegradatiestudies gemakkelijk biologisch afbreekbare eigenschappen voor calciumcarbide en zijn afbraakproducten.
Referentie
- Calciumcarbide; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_533.pub2
