Benzeensulfonzuur: eigenschappen, productie en toepassingen

Wat is benzeensulfonzuur?
Benzeensulfonzuur is het eenvoudigste aromatische sulfonzuur, met de formule C6H5SO3H. Het ziet eruit als fijne, delicate naalden of grote platen.
Benzeensulfonzuur werd voor het eerst gesynthetiseerd, samen met difenylsulfon, door E. Mitscherlich in 1834 door de reactie van benzeen met rokend zwavelzuur. Tot begin jaren 60 werd benzeensulfonzuur voornamelijk gebruikt bij de productie van fenol.
Inhoudsopgave
1. Fysische eigenschappen van benzeensulfonzuur
Benzeensulfonzuur kristalliseert uit een waterige oplossing als een deliquescent hydraat met 1,5 moleculen water per molecuul benzeensulfonzuur. Deze vorm smelt bij een temperatuur van 43–44 °C. Er bestaat ook een monohydraat (één watermolecuul per zuurmolecuul), dat smelt bij 45–46 °C.
Het verwijderen van water levert watervrij benzeensulfonzuur op. Deze vorm heeft een hoger smeltpunt (65–66 °C) en kan zonder ontleding worden gedestilleerd bij 171–172 °C onder lage druk (0,13 mbar).
Benzeensulfonzuur is zeer oplosbaar in water en alcoholen, is licht oplosbaar in benzeen en is onoplosbaar in di-ethylether en koolstofdisulfide.
De diëlektrische constante van benzeensulfonzuur in een waterige oplossing is 0,2.
Belangrijke fysische eigenschappen van benzeensulfonzuur staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [98-11-3] |
| Chemische formule | C6H6SO3 |
| Moleculaire massa | 158,17 g/mol |
| Smeltpunt | 51 °C |
| Kookpunt | 190 °C |
| Dichtheid | 1,3 g/cm3 |
| pKa | -2,8 |
| Dampdichtheid | 5,5 |
| Vlampunt | 113 °C |
2. Chemische reacties van benzeensulfonzuur
Benzeensulfonzuur vertoont typische reacties van een sterk aromatisch sulfonzuur. Zure hydrolyse bij 175 °C levert benzeen en zwavelzuur op.

Verdere sulfonering met rokend zwavelzuur produceert 1,3-benzeendisulfonzuur, dat kan worden omgezet in 1,3,5-benzeentrisulfonzuur en difenylsulfondisulfonzuur.

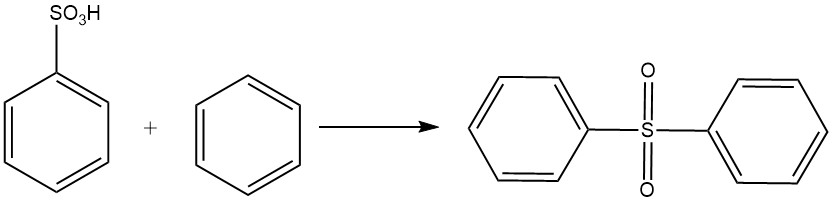
Benzeensulfonzuur ondergaat een Friedel-Crafts-achtige reactie met benzeen om difenylsulfon te vormen.
Benzeensulfonzuur reageert met alkali natriumhydroxide bij 320-350 °C om natriumfenolaat te produceren volgens de volgende vergelijking:
C6H5SO3Na + 2 NaOH → C6H5ONa + Na2SO3 + H2O
Deze reactie vormde de basis voor de eerste industriële productie van fenol.

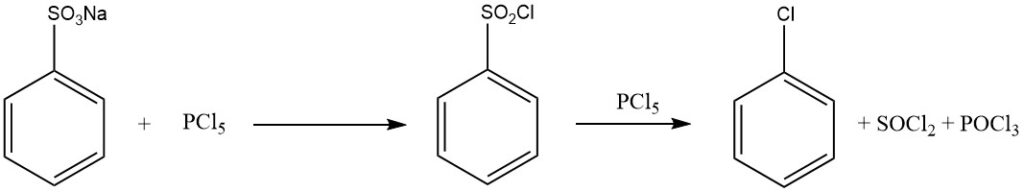
Behandeling van benzeensulfonzuur met fosforhalogeniden (PCl5, PBr5), chloorzwavelzuur, thionylchloride of fosgeen levert sulfonylhalogeniden op:
C6H5SO2OH + PCl5 → C6H5SO2Cl + POCl3 + HCl
Wanneer een overmaat aan PCl5 wordt gebruikt, wordt chloorbenzeen gevormd volgens naar:
C6H5SO2Cl + PCl5 → C6H5Cl + SOCl2 + POCl3
Benzeensulfonzuuranhydride wordt gesynthetiseerd door benzeensulfonzuur te laten reageren met P2O5, SOCl2 of SO3. Het kan ook worden gevormd als bijproduct tijdens de bereiding van benzeensulfonzuur of benzeensulfonylchloride. In deze gevallen worden ze echter vaak niet waargenomen vanwege hun snelle hydrolyse in waterig zuur.

Benzeensulfonzuuresters worden geproduceerd door de reactie van sulfonzuur of sulfonylchloriden met alcoholen; bijvoorbeeld methylbenzeensulfonaat uit methanol, ethylbenzeensulfonaat uit ethanol en isopropylbenzeensulfonaat uit isopropanol.
3. Productie van benzeensulfonzuur
Benzeensulfonzuur wordt geproduceerd door een exotherme reactie tussen benzeen en zwavelzuur, zoals beschreven door de vergelijking:
C6H6 + H2SO4 → C6H5SO3H + H2O

De reactie bereikt evenwicht bij een specifieke zwavelzuurconcentratie tussen 74 en 78%, wat afhankelijk is van de temperatuur en de vorming van water.
Een aanzienlijk deel van het zwavelzuur, ongeveer 45% in het traditionele proces, blijft ongebruikt en fungeert als oplosmiddel en verdunningsmiddel. Deze overmaat helpt de vorming van bijproducten zoals difenylsulfon te minimaliseren. In industriële omgevingen wordt calciumcarbonaat gebruikt om het overtollige zuur te verwijderen.
Er zijn verschillende methoden industrieel geïmplementeerd om overtollig zwavelzuur te verminderen, die allemaal leiden tot een lichte toename van sulfonvorming door:
- Zwavelzuur vervangen door oleum (rokend zwavelzuur) of zuiver zwaveltrioxide.
- Benzeensulfonzuur extraheren uit het reactiemengsel met behulp van benzeen.
- Continu water verwijderen dat tijdens de reactie is gevormd met behulp van benzeen door azeotropische destillatie.
Het klassieke proces is niet langer commercieel relevant omdat het was gekoppeld aan fenolproductie (het gebruik van sulfiet uit fenolproductie om het benzeensulfonzuur te neutraliseren).
3.1. Productie van benzeensulfonzuur door continue sulfonering met oleum (Monsanto-proces)
Dit proces omvat het gelijktijdig toevoeren van benzeen en oleum aan een cascade van zes sulfoneringsvaten die zijn uitgerust met roerders. De eerste twee vaten worden gekoeld, terwijl de andere worden verwarmd. Optimale temperatuurregeling zorgt voor een volledige reactie tegen de tijd dat het mengsel het laatste vat verlaat.
Overtollig zwavelzuur wordt geneutraliseerd met natriumsulfiet of natriumhydroxideoplossing, wat leidt tot neerslag van natriumsulfaat. De oplossing met natriumbenzeensulfonaat wordt geconcentreerd, wat leidt tot verdere neerslag van natriumsulfaat.
Na scheiding kan het benzeensulfonzuur direct worden omgezet in fenol of worden gedroogd. Dit proces gebruikt doorgaans oleum met 35,6% zwaveltrioxide en handhaaft temperaturen tussen 70-80 °C en 110 °C in respectievelijk het eerste en laatste vat. Ongeveer 1% van de benzeen wordt omgezet in difenylsulfon.
3.2. Productie van benzeensulfonzuur door continu extractieproces
Deze methode omvat het krachtig roeren van overtollig benzeen en zwaveltrioxide die afzonderlijk in de bodem van een vat worden geïntroduceerd. Een benzeenlaag verzadigd met benzeensulfonzuur verzamelt zich bovenaan en stroomt over in een tweede vat.
Hier wordt het benzeensulfonzuur uit de benzeen geëxtraheerd door continu te wassen met water of natriumhydroxideoplossing. De gescheiden benzeenlaag wordt vervolgens gedroogd en teruggevoerd naar het reactievat.
Dit proces bereikt een zwavelzuurverbruik van 1260 kg per 1000 kg omgezet benzeen, met difenylsulfonvorming onder de 2%.
3.3. Productie van benzeensulfonzuur door azeotropische verwijdering van reactiewater
Dit proces omvat het verwarmen van zwavelzuur (ongeveer 79% concentratie) tot 170 °C in een vat. Fijn verdeelde benzeendamp wordt via een geperforeerde plaat aan de onderkant ingebracht. Een deel van de overtollige benzeendamp ondergaat sulfonering, terwijl de resterende benzeen continu het gevormde water verwijdert via azeotropische destillatie.
Het benzeen-waterdampmengsel dat het vat verlaat, wordt gecondenseerd en het gescheiden benzeen wordt teruggevoerd naar de verdamper. Continue werking levert een eindproduct op dat ongeveer 80,2% benzeensulfonzuur en 14,3% zwavelzuur bevat.
Batchbewerkingen kunnen een product produceren met 93,1% benzeensulfonzuur en 4,8% zwavelzuur. Door natriumbenzeensulfonaat aan het reactiemengsel toe te voegen, kan de sulfonvorming verder worden teruggebracht tot onder de 2%.
4. Toepassingen van benzeensulfonzuur
Benzeensulfonzuur wordt gebruikt voor diverse toepassingen in verschillende industrieën, zoals:
Fenolproductie: Benzeensulfonzuur wordt gebruikt om fenol te produceren door fusie met natriumhydroxide of hydrolyse van de zouten ervan, meestal het natriumzout.
Surface-actieve stofsynthese: Benzeensulfonzuur is een belangrijk onderdeel bij de creatie van surfactanten, met name in combinatie met metaal- of aminezouten. Zouten van benzeensulfonzuur, zoals natriumbenzeensulfonaat (Ludigol) en monoethanolaminebenzeensulfonaat, worden gebruikt als surfactanten in wasmiddelformuleringen.
Farmaceutische geneesmiddelensynthese: Benzeensulfonzuur is betrokken bij de synthese van farmaceutische geneesmiddelen, waarbij deze geneesmiddelen worden geproduceerd als benzeensulfonaatzouten. Deze zouten worden herkend door de International Nonproprietary Name als besilates of de United States Adopted Name als besylates.
Zuurkatalysator: De zure aard van benzeensulfonzuur maakt het waardevol als zuurkatalysator in verschillende chemische reacties.
Standaardisatie van kleurstoffen: Het natriumzout van benzeensulfonzuur speelt een rol bij het standaardiseren van kleurstoffen en zorgt voor de nauwkeurigheid van kleurprocessen.
Surface-enhanced oil recovery (SEOR): Benzeensulfonzuur is essentieel in SEOR, een techniek waarbij oppervlakteactieve stoffen worden gebruikt om de extractie van olie uit reservoirs te vergemakkelijken, ook bekend als surfactant flushing.
5. Toxicologie van benzeensulfonzuur
Benzeensulfonzuur brengt potentiële gezondheidsrisico’s met zich mee bij blootstelling door inademing en inname.
Inademing kan irritatie van de luchtwegen veroorzaken, gekenmerkt door hoesten, keelpijn, kortademigheid en een branderig gevoel in de longen. Hoofdpijn en misselijkheid kunnen ook gepaard gaan met deze symptomen.
Huidcontact met het zuur leidt tot irritatie en brandwonden, met roodheid, brandende pijn en mogelijke blaarvorming.
Blootstelling aan de ogen kan eveneens ernstige brandwonden en permanente schade aan het gezichtsvermogen veroorzaken.
Inname van benzeensulfonzuur resulteert in irritatie en branderigheid van de keel en borst, samen met buikpijn en mogelijk zelfs shock of collaps.
Gegevens over acute toxiciteit omvatten:
- Orale LD50 (ratten): 890 uL/kg
- Huid LDLo (katten): 10 mg/kg
- Orale LD50 (vogels): 75 mg/kg
Blootstelling aan benzeensulfonzuur kan leiden tot ernstigere gezondheidsproblemen. De corrosieve aard van het zuur kan brandwonden op de huid en ogen veroorzaken. Inademing van het zuur kan de longen ontsteken, een aandoening die bekendstaat als toxische pneumonitis.
Hoewel het over het algemeen niet wordt beschouwd als een aandoening die op de lange termijn gezondheidseffecten veroorzaakt, is voorzichtigheid toch geboden. Contact met verhitte dampen of de gesublimeerde vorm (vaste stoffen die direct in gas overgaan) kan de bovenste luchtwegen, ogen en huid irriteren.
Dierstudies ondersteunen de potentiële gevaren van blootstelling aan benzeensulfonzuur. Cavia’s ontwikkelden ernstige huidirritatie bij contact en oogtesten bij konijnen wezen op aanzienlijk letsel.
Referenties
- Benzenesulfonic Acids and Their Derivatives; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_507
- BENZENESULFONIC ACID – ILO
- https://www.acs.org/molecule-of-the-week/archive/b/benzenesulfonic-acid.html
- https://en.wikipedia.org/wiki/Benzenesulfonic_acid
- Benzenesulfonic Acid (Surfactant)
Ik ben een gepassioneerde organische chemicus en leer voortdurend over verschillende industriële chemische processen en chemische producten. Ik zorg ervoor dat alle informatie op deze website accuraat is en nauwgezet verwijst naar wetenschappelijke artikelen.
