1-Propanol: Eigenschappen, Reacties, Productie en Toepassingen
Wat is 1-propanol?
1-Propanol, ook wel n-propylalcohol of propaan-1-ol genoemd, is een primaire alcohol met de chemische formule CH3CH2CH2OH. Het is een heldere, kleurloze vloeistof met een karakteristieke alcoholische geur en is mengbaar met water, ethanol en ether.
1-Propanol is een structureel isomeer van isopropylalcohol, maar deze laatste is van groter industrieel belang vanwege het wijdverbreide gebruik als oplosmiddel en desinfectiemiddel.
In de natuur komt 1-propanol voor in foezeloliën en ontstaat het als een bijproduct van fermentatie en tijdens het bederf of de ontbinding van plantaardig materiaal.
Inhoudsopgave
1. Fysische eigenschappen van 1-propanol
1-Propanol is een heldere, kleurloze vloeistof met een karakteristieke alcoholische geur. Het is volledig mengbaar met water en gemakkelijk oplosbaar in vele organische oplosmiddelen, waaronder ethers, esters, zuren, ketonen en andere alcoholen.
De fysische eigenschappen van n-propanol zijn samengevat in tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-registratienummer | 71-23-8 |
| Chemische formule | C3H8O |
| Molaire massa, g/mol | 60,09 |
| Vriespunt, °C | −126,2 |
| Kookpunt, °C | 97,20 |
| Dampspanning, kPa | bij 20 °C: 1,987 bij 40 °C: 6,986 bij 60 °C: 20,292 bij 80 °C: 50,756 |
| Antoine-vergelijking (2–120 °C, t in °C) | log P(kPa) = 6,97257 − 1499,21 / (204,64 − t) |
| Dampdichtheid (lucht = 1) | 2,07 |
| Dichtheid bij 20 °C, g/cm3 | 0,80375 |
| Francis-vergelijking (-21 tot 180 °C, t in °C) | Dichtheid = 0,8813 + (5,448 × 10-4 t) - 21,536 / (313,09 - t) |
| Breukindex, nD20 | 1,38556 |
| Viscositeit bij 20 °C, mPa·s | 2,256 |
| Oppervlaktespanning bij 20 °C, mN/m | 23,75 |
| Kritische temperatuur, °C | 263,65 |
| Kritische druk, kPa | 5169,60 |
| Kritische dichtheid, g/cm3 | 0,275 |
| Warmtecapaciteit (vloeistof, 25 °C), J/(mol·K) | 141 |
| Verdampingswarmte, kJ/mol | bij 25 °C: 47,53 bij 97,20 °C: 41,78 |
| Verbrandingswarmte (vloeistof, 25 °C), kJ/mol | 2033 |
| Vormingswarmte (damp, 25 °C), kJ/mol | −254,7 |
| Vlampunt (Tag open cup), °C | 28,9 |
| Zelfontbrandingstemperatuur, °C | 371,1 |
| Explosiegrenzen in lucht, vol.% | Onder: 2,2 Boven: 14,0 |
| Elektrische geleidbaarheid bij 25 °C, S | 2 × 10-8 |
2. Chemische reacties van 1-propanol
De chemische eigenschappen van 1-propanol zijn kenmerkend voor primaire alcoholen met een laag molecuulgewicht. Het ondergaat diverse reacties die kenmerkend zijn voor de hydroxylgroep, waaronder oxidatie, verestering, aminering, dehydratie en verethering. In biologische systemen wordt 1-propanol gemakkelijk afgebroken en wordt het beschouwd als een van de gemakkelijkst biologisch afbreekbare alcoholen.
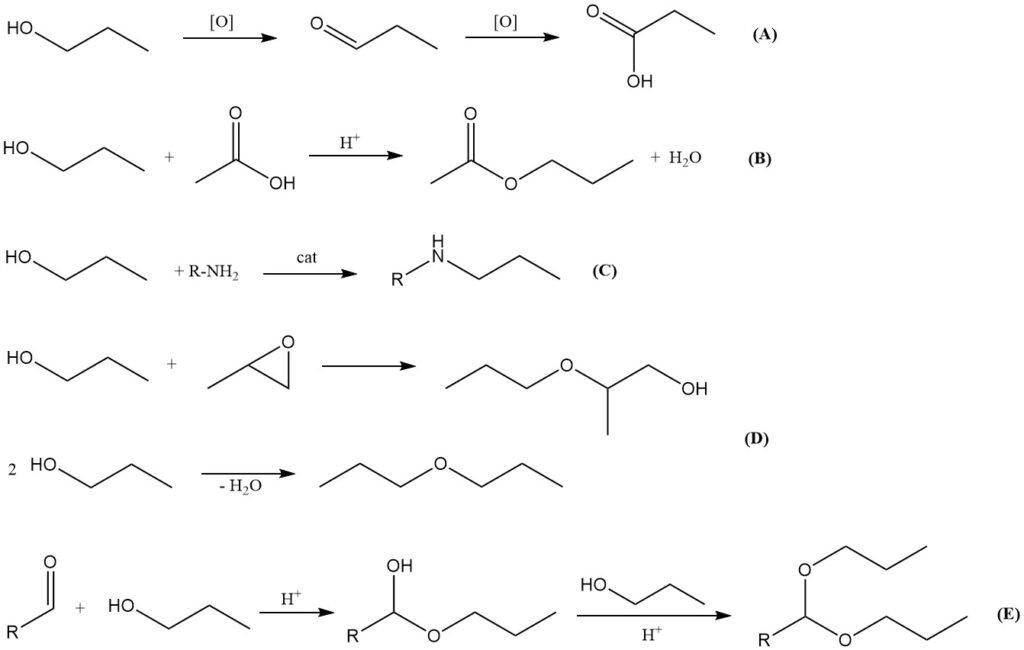
Oxidatie (A)
Oxidatie van 1-propanol verloopt eerst tot het overeenkomstige aldehyde, propanal, en vervolgens tot propionzuur. Gedeeltelijke oxidatie kan worden bereikt met behulp van lucht in aanwezigheid van metaalgebaseerde katalysatoren zoals koperchromiet, chroom(VI)oxiden of pyridiniumzouten.
Verestering (B)
Net als andere alcoholen reageert 1-propanol met organische en anorganische zuren om esters te vormen. Reactie met azijnzuur in aanwezigheid van sterk zure katalysatoren (bijv. zwavelzuur, p-tolueensulfonzuur, methaansulfonzuur of ionenwisselaarharsen) levert n-propylacetaat op, een belangrijk oplosmiddel dat wordt gebruikt in coatings, inkten en de parfumindustrie.
Transesterificatie met methyl- of ethylacetaat kan ook worden gebruikt om n-propylacetaat te produceren.
Aminatie (C)
1-Propanol kan reductieve aminering ondergaan met ammoniak of aminen onder verhoogde temperatuur en druk in aanwezigheid van overgangsmetaalkatalysatoren zoals nikkel, kobalt of molybdeen. Deze reactie produceert propylaminederivaten, hoewel deze van minder industrieel belang zijn in vergelijking met de overeenkomstige isopropylaminederivaten.
Verethering en dehydratie (D)
De reactie van 1-propanol met alkyleenoxiden (bijv. ethyleenoxide, propyleenoxide) levert glycolethers op, die veel als oplosmiddelen worden gebruikt. Dehydratie van 1-propanol kan di-n-propylether produceren met behulp van vaste zure katalysatoren. Dehydratie tot propeen is ook mogelijk, maar heeft geen praktische industriële betekenis.
Acetaalvorming (E)
Net als andere primaire alcoholen reageert 1-propanol met aldehyden tot hemiacetalen, die in aanwezigheid van zure katalysatoren onder dehydrerende omstandigheden verder kunnen worden omgezet in acetalen. Acetalen afgeleid van 1-propanol dienen als tussenproducten in de farmaceutische synthese.
3. Industriële productie van 1-propanol
1-propanol wordt voornamelijk industrieel geproduceerd door hydroformylering (oxoproces) van etheen tot propanal (propionaldehyde), gevolgd door katalytische hydrogenering tot alcohol.
Een dampfase-oxidatieproces van propaan werd ooit gebruikt, uitgevoerd door Celanese in Bishop, Texas, maar deze route werd in 1973 stopgezet. Sindsdien is de oxo-technologie de belangrijkste methode in de Verenigde Staten en Europa.
In Zuid-Afrika produceert Sasol 1-propanol via Fischer-Tropsch-synthese. Pogingen om 1-propanol te produceren door anti-Markovnikov-hydratatie van propeen zijn onderzocht, maar hebben nog geen commerciële toepassing bereikt.
3.1. Productie van 1-propanol door hydroformylering en hydrogenering
De commerciële productie van 1-propanol door hydroformylering (oxoproces) bestaat uit twee stappen. Ethyleen wordt eerst omgezet in propanal door hydroformylering met synthesegas (1), gevolgd door katalytische hydrogenering van propanal tot 1-propanol (2).
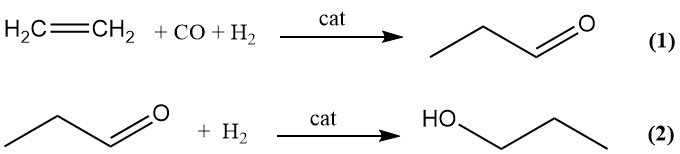
Kleinere bijproducten van de hydroformyleringsstap zijn onder andere propaan, 1-propanol en zware deeltjes gevormd door aldolcondensatie. Carbonylcomplexen van overgangsmetalen van kobalt, ijzer, nikkel, rhodium en iridium kunnen de oxoreactie katalyseren, maar alleen kobalt en rhodium worden commercieel gebruikt.
In de Verenigde Staten wordt 1-propanol geproduceerd met behulp van oxotechnologie bij Texas Eastman, Union Carbide en Hoechst Celanese. Texas Eastman werkte oorspronkelijk met HCo(CO)4-katalysatoren op basis van kobalt en ging later in 1989 over op een fosfine-gemodificeerd rhodiumsysteem. In Europa wordt de productie uitgevoerd door Hoechst AG en BASF AG.
De rhodium-trifenylfosfinekatalysator heeft kobaltkatalysatoren grotendeels vervangen vanwege de hogere reactiesnelheden, verbeterde stabiliteit, lagere bedrijfsdrukken en minder bijproducten. Rhodiumcarbonylen zijn geschikt voor installaties die oorspronkelijk ontworpen waren voor kobaltkatalysatoren.
Hoewel rhodium hogere drukken vereist, is de activiteit ervan groter en produceert het minder hoogkokende fracties. Bij Hoechst AG in Duitsland (Werk Ruhrchemie) worden rhodiumcarbonylen gebruikt voor de synthese van propanal, dat vervolgens wordt gehydrogeneerd tot 1-propanol. Rhodiumcarbonylen zouden 100-1000 keer reactiever zijn dan kobaltanalogen.
Ethyleenhydroformylering met rhodiumkatalysatoren wordt uitgevoerd bij 90-120 °C, 2,17-3,55 MPa, een H2:CO-verhouding van 1:1-3:1, rhodiumconcentraties van 1-10 mM en trifenylfosfineconcentraties van 0,1-0,4 M. Onder deze omstandigheden bereikt de propanalopbrengst 98-99%, met een omzetting van 0,5-1,0% naar ethaan en zware fracties.
De katalysatoractiviteit wordt onderdrukt door halogeenhoudende rhodiumbronnen, omdat gehalogeneerde complexen een slechte hydroformyleringsprestatie vertonen. De meest actieve katalysatorprecursor is hydridocarbonyltris(trifenylfosfine)rhodium, HRhCO\[P(C6H5)3]3, dat actieve deeltjes genereert door dissociatie van een trifenylfosfineligand.
Overtollig trifenylfosfine onderdrukt de deactivering van de katalysator, veroorzaakt door fenylmigratie van fosfor naar rhodium, wat anders leidt tot inactieve rhodium-fosfideclusters.
De hydrogenering van propanal tot 1-propanol is een gangbaar proces. Nikkelgebaseerde katalysatoren, zoals Raney-nikkel of gedragen nikkel, en koper-chroomoxidekatalysatoren worden vaak gebruikt. Zowel dampfase- als vloeistoffasehydrogeneringsmethoden worden gebruikt.
De vloeistoffase wordt uitgevoerd bij 2,17–4,24 MPa en 100–170 °C. Hydrogenering in de dampfase werkt doorgaans onder 790 kPa. Er worden reactorconfiguraties met een vast bed, slurrybed of tricklebed gebruikt. Er worden opbrengsten van 1-propanol van meer dan 95% bereikt.
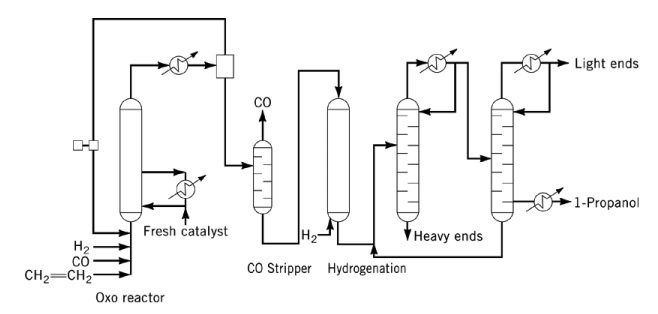
Bijproducten zijn onder andere acetalen, ethers, esters en diolen. Zowel CO als trifenylfosfine fungeren als katalysatorgif en moeten vóór hydrogenering uit de voeding worden verwijderd.
In industriële processen wordt propanoldamp uit het oxoreactoreffluent verwijderd met behulp van overtollig synthesegas, gevolgd door condensatie en CO-verwijdering vóór hydrogenering. De resulterende ruwe 1-propanol wordt gezuiverd in een tweekolomsdestillatiesysteem.
Bij gebruik van kobaltcarbonyl- of rhodiumcarbonylkatalysatoren is vloeistofonttrekking van propanol noodzakelijk vanwege de hogere reactordrukken en zijn aanvullende voorzieningen voor katalysatorwinning en -verwerking vereist.
3.2. Productie van 1-propanol via het Sasol Fischer-Tropsch-proces
Sasol produceert 1-propanol als secundair product van de Fischer-Tropsch-synthese. In dit proces wordt steenkool vergast in Lurgi-reactoren met een vast bed om synthesegas (CO en H2) te genereren. De gasstroom wordt gescheiden van condenseerbare componenten, gezuiverd en in de Sasol Synthol-eenheid gebracht.
In wervelbedreactoren wordt het gas in contact gebracht met een fijn verdeelde katalysator op ijzerbasis, waarbij de zeer exotherme Fischer-Tropsch-reactie een mengsel van koolwaterstoffen en zuurstofhoudende verbindingen oplevert.
De condensaten uit de reactoren scheiden zich in een koolwaterstoffractie en een waterige fase. De waterige stroom bevat een mengsel van alcoholen en ketonen. De meeste alcoholen worden gemengd tot benzine met een hoog octaangehalte, terwijl geselecteerde alcoholfracties worden gedestilleerd om zuivere producten te winnen.
Uit deze processen worden 1-propanol en ethanol geïsoleerd in een scheidingssysteem met meerdere units met een totale jaarlijkse capaciteit van ongeveer 25.000–30.000 ton.
4. Toepassingen van 1-propanol
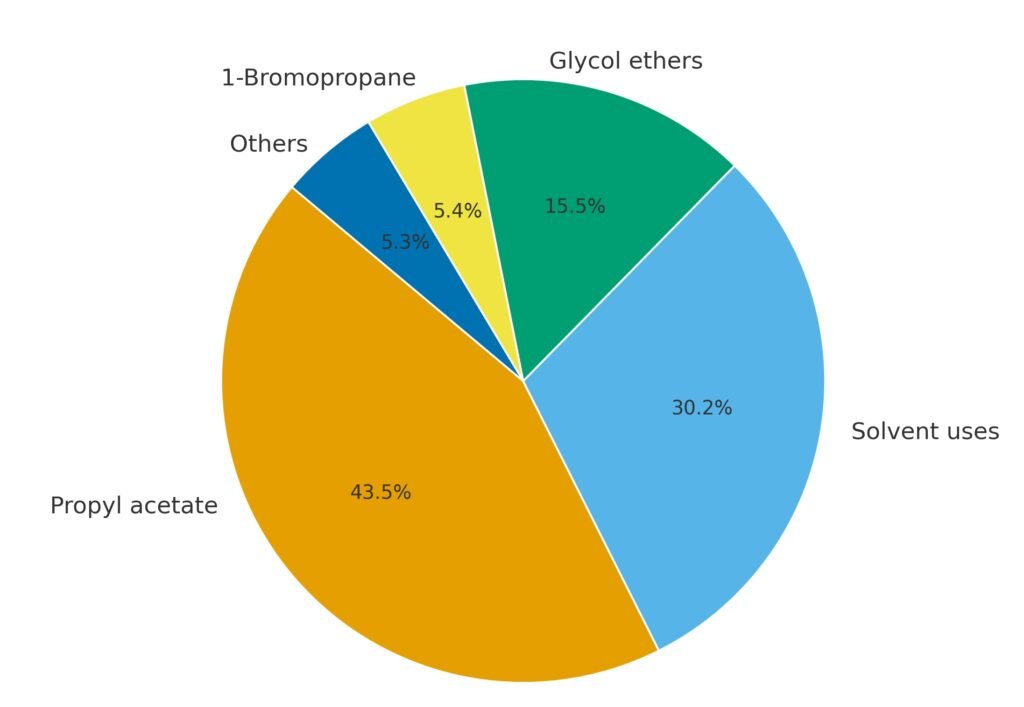
1-Propanol wordt voornamelijk gebruikt als oplosmiddel en als chemisch tussenproduct. Het belangrijkste derivaat is n-propylacetaat, dat het grootste deel van de wereldwijde consumptie vertegenwoordigt.
1-Propanol wordt veel gebruikt als oplosmiddel in flexo- en diepdrukinkten, met name voor het bedrukken van polyolefine- en polyamidefilms. Vergeleken met ethanol en 2-propanol biedt het voordelen op het gebied van afdrukkwaliteit en drooggedrag. Het wordt ook gebruikt als oplosmiddel in verven, coatings, cosmetica, pesticiden en insecticiden.
In Europa is 1-propanol steeds belangrijker geworden als ingrediënt in hand- en oppervlaktedesinfectiemiddelen vanwege de hoge biocide werking tegen bacteriën, schimmels en virussen.
Een groot deel van 1-propanol wordt omgezet in n-propylacetaat, dat wordt gebruikt als oplosmiddel in inkten, lakken, cellulosederivaten, wassen en insecticiden. Andere esters, zoals n-propylpropionaat, worden gebruikt in coatings en worden beschouwd als vervangers van n-butylacetaat vanwege de verbeterde geureigenschappen.
1-Propanol is een grondstof voor de productie van glycolethers, zoals ethyleenglycolmonopropylether, diethyleenglycolmonopropylether, propyleenglycolmonopropylether en dipropyleenglycolmonopropylether. Deze oplosmiddelen combineren een hoog oplossend vermogen met watercompatibiliteit en worden gebruikt in coatings en reinigingsmiddelen.
In Europa wordt een aanzienlijk deel van 1-propanol omgezet in propylamines, die als tussenproducten dienen bij de productie van herbiciden en farmaceutische producten.
1-Propanol is een precursor van 1-broompropaan, een oplosmiddel dat wordt gebruikt als vervanger voor methyleenchloride en ozonafbrekende stoffen.
Kleinere toepassingen zijn onder meer het gebruik als smaak- en geurstof, als co-solvent in pesticideformuleringen en als diervoederadditief.
5. Toxicologie van 1-propanol
1-propanol is geclassificeerd als een ontvlambare vloeistof met een vlampunt lager dan 38 °C. Het is gereguleerd als gevaarlijke stof door de Occupational Safety and Health Administration (OSHA) onder 29 CFR 1910.1200.
Toxiciteitsstudies tonen aan dat 1-propanol slechts licht toxisch is voor dieren (tabel 2). De Ames-test en de Mouse Lymphoma Forward Mutation Assay leveren negatieve resultaten op, wat wijst op geen mutageen potentieel.
| Toedieningsmethode / Parameter | Waarde |
|---|---|
| Orale dosis, ratten, LD50 | 1,9 g/kg |
| Dermaal, konijnen, LD50 | 5,4 g/kg |
| Inhalatie, ratten, LC50 | 24.000 ppm |
| ACGIH TLV, TWA | 200 ppm |
| Gevarenclassificaties (NFPA: Gezondheid, Ontvlambaarheid, Reactiviteit) | 1, 3, 0 |
| Gevarenclassificaties (HMIS: Gezondheid, Ontvlambaarheid, Reactiviteit) | 2, 3, 0 |
| Opmerkingen: LD50 = mediane letale dosis. LC50 = mediane letale concentratie. TLV = Drempelwaarde, TWA = tijdgewogen gemiddelde. | |
Het National Toxicology Program (NTP) en het International Agency for Research on Cancer (IARC) classificeren 1-propanol niet als kankerverwekkend. Acute blootstelling kan oogirritatie of brandwonden veroorzaken, terwijl herhaald huidcontact kan leiden tot dermatitis. Inademing van overmatige dampconcentraties kan de ogen en luchtwegen irriteren, en zeer hoge concentraties kunnen een narcotisch effect hebben.
In de Verenigde Staten valt 1-propanol onder de Comprehensive Environmental Response, Compensation, and Liability Act (CERCLA) met een meldbare hoeveelheid van 45,4 kg per dag.
Het is ook opgenomen in de atmosferische emissienormen onder 40 CFR 60.489, die beheersing van de uitstoot van vluchtige organische stoffen door productieapparatuur vereisen. Verschillende Amerikaanse staten vermelden 1-propanol onder de ‘right-to-know’-regelgeving.
In de regelgeving voor levensmiddelen en pesticiden is 1-propanol toegestaan als smaakstof en adjuvans onder 21 CFR 172.515 en is vrijgesteld van de tolerantievereisten bij gebruik als oplosmiddel of co-solvent in pesticideformuleringen.
Referenties
1. Unruh, J.D. and Pearson, D. (2000). n-Propyl Alcohol. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.1618151621141821.a01
2. Klabunde, J., Bischoff, C. and Papa, A.J. (2025). Propanols. In Ullmann’s Encyclopedia of Industrial Chemistry. https://doi.org/10.1002/14356007.a22_173.pub3
