Cyanuurchloride: eigenschappen, reacties, productie en toepassingen
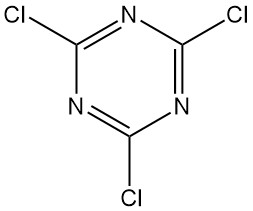
Wat is cyanuurchloride?
Cyanuurchloride, ook bekend als 2,4,6-trichloor-1,3,5-triazine, is een organische verbinding met de formule C3N3Cl3. Het verschijnt als een kleurloze, kristallijne vaste stof met een scherpe geur. Het is het gechloreerde derivaat van 1,3,5-triazine en het trimeer van cyanogeenchloride.
Inhoudsopgave
1. Fysische eigenschappen van cyanuurchloride
Cyanuurchloride vormt kleurloze monokliene kristallen met een scherpe geur, die doet denken aan acetamide en zuurchloriden. Het is oplosbaar in de meeste organische oplosmiddelen, maar onoplosbaar in water.
Tabel 1 toont de oplosbaarheid (in gew.%) van cyanuurchloride in verschillende oplosmiddelen bij 25 °C.
| Oplosmiddel | Oplosbaarheid (gew.%) |
|---|---|
| Aceton | 25,0 |
| Acetonitril | 21,0 |
| Acrylonitril | 19,0 |
| Benzeen | 19,0 |
| Chloorbenzeen | 16,0 |
| Tetrachloormethaan | 7,5 |
| Di-ethylether | 14,0 |
| Dioxaan | 55,0 |
| Ethylacetaat | 21,0 |
| Methylvinylketon | 27,0 |
| Nitrobenzeen | 18,0 |
| Tetrahydrofuraan | 43,0 |
| Trichloormethaan | 20,0 |
| Tolueen | 18,5 |
Cyanuurchloride sublimeert voordat het kookpunt bereikt wordt. De dampspanning van het vloeibare cyanuurchloride als functie van de temperatuur wordt gegeven door de volgende vergelijking:
ln p (mmHg) = -0,33480-742,7311/T(K)+11,15147 ln T(K)
Belangrijke fysische eigenschappen van cyanuurchloride staan in de volgende tabel.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [108-77-0] |
| Formule | C3N3Cl3 |
| Moleculair gewicht | 184,5 g/mol |
| Tripelpunt | 145,7 °C bij 255 kPa |
| Kookpunt punt | 194 °C |
| Dichtheid (vast) | 1,92 g/cm3 |
| Dichtheid (smelt) | 1,48 g/cm3 |
| Warmtecapaciteit | 0,99 kJ kg-1 K-1 bij 150 °C |
| Smeltwarmte | 123 kJ/kg |
| Verdampingswarmte | 256 kJ/kg |
2. Reacties van cyanuurchloride
Onder watervrije omstandigheden fungeert cyanuurchloride als een chloreringsmiddel. Alcoholen en tertiaire aminen worden omgezet in alkylchloriden, terwijl carbonzuren in watervrije aceton met triethylamine zuurchloriden vormen, die geïsoleerd worden of in situ worden gebruikt voor de productie van esters en amiden. In beide gevallen is cyanuurzuur een bijproduct.
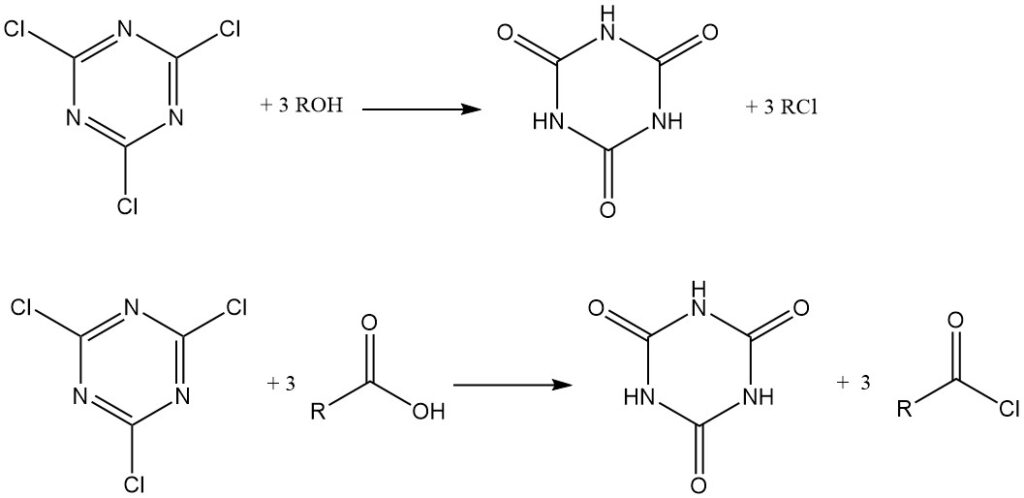
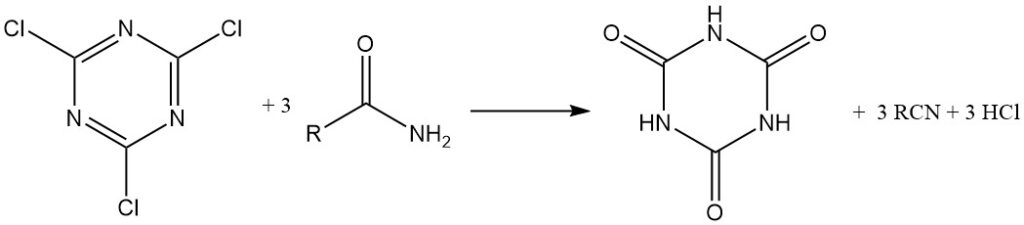
Het kan ook worden gebruikt als condensatie (dehydratie) reagens. Amiden, thioamiden en aldoximen kunnen worden omgezet in nitrillen.
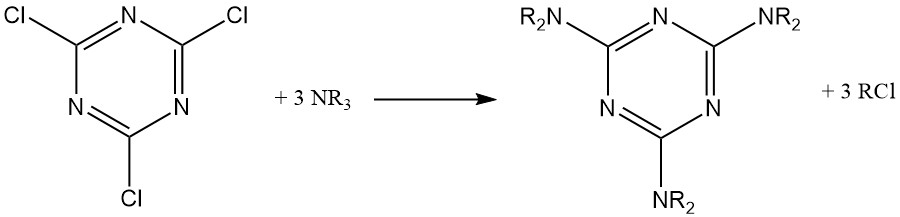
Onder watervrije omstandigheden reageren tertiaire alifatische aminen met cyanuurchloride om gesubstitueerde melaminederivaten te vormen, waarbij één alkylgroep wordt omgezet in het overeenkomstige alkylchloride.
Cyanuurchloride reageert doorgaans als zuurchloride, waarbij waterstofchloride ontstaat. Terwijl een suspensie in ijswater enige stabiliteit vertoont (tot 12 uur bij 0 °C), wordt hydrolyse versneld wanneer de temperatuur stijgt, met meer dan 40% gehydrolyseerd binnen 1 uur bij 30 °C. Cyanuurzuur is het uiteindelijke hydrolyseproduct.
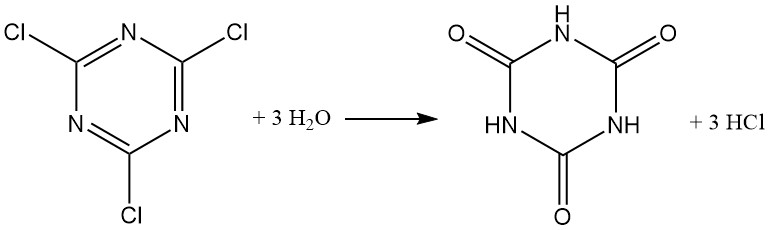
Alkalische waterige media (NaOH of NaHCO3 bij 40 °C) bevorderen de vorming van 2,4-dichloor-6-hydroxy-1,3,5-triazine. Overtollige base levert 2,4-dihydroxy-6-chloor-1,3,5-triazine op. Trinatriumcyanuraatvorming vindt alleen plaats boven 125 °C.
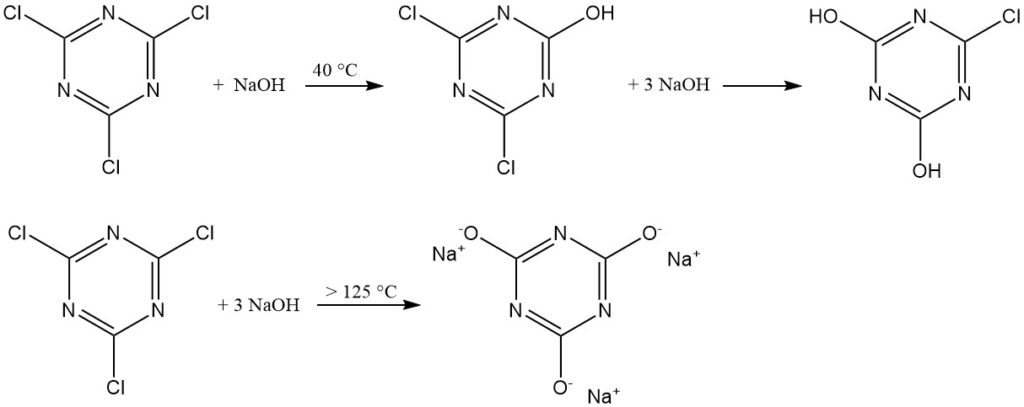
De tijdelijke stabiliteit van cyanuurchloride in water maakt reacties met sterke nucleofielen (zoals alcoholen, thiolen en primaire en secundaire aminen) in ijswatersuspensies mogelijk. Deze reacties verlopen vaak stapsgewijs om trisubstitutie bij gecontroleerde temperaturen te bereiken.
Een empirische regel suggereert om het eerste chloor te vervangen bij 0–5 °C, het tweede bij 30–50 °C en het derde bij 70–100 °C voor aminesubstituenten. HCl-vangers omvatten natriumhydroxide, natriumwaterstofcarbonaat, dinatriumwaterstoffosfaat en tertiaire aminen.
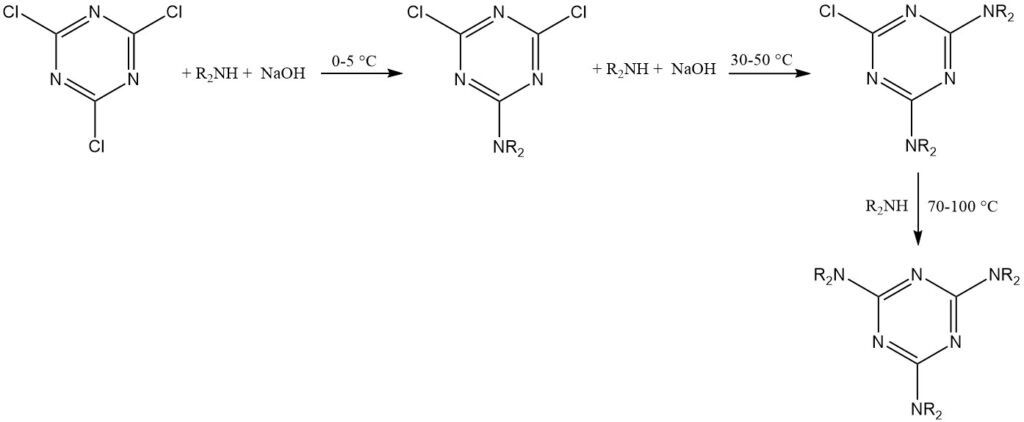
Het triazineproduct wordt doorgaans geïsoleerd door filtratie of centrifugatie. Aceton, methylethylketon of tolueen zijn veelgebruikte oplosmiddelen voor deze reacties.
Cyanuurchloride (smelt of poeder) wordt opgelost/gesuspendeerd in het oplosmiddel met de nucleofiel en vervolgens behandeld met waterige NaOH. Het product wordt geïsoleerd uit de organische laag door verdamping of filtratie.
Deze methode maakt de opeenvolgende introductie van verschillende substituenten bij verschillende temperaturen mogelijk. Hoogkokende oplosmiddelen of de gesmolten reactant kunnen nodig zijn om het derde chlooratoom te vervangen.
De neutralisatie van vrijgekomen zoutzuur en warmteafvoer tijdens reacties zijn cruciaal. Exotherme hydrolyse van cyanuurchloride (ΔH = -2164 kJ/kg) kan oncontroleerbaar worden, vooral bij de productie van cyanuraat uit alcoholen.
Met water mengbare oplosmiddelen versnellen hydrolyse. Het opslaan van cyanuurchloride-oplossingen in waterige aceton zonder de juiste warmteafvoer kan leiden tot onbeheersbare reacties, zelfs bij kamertemperatuur.
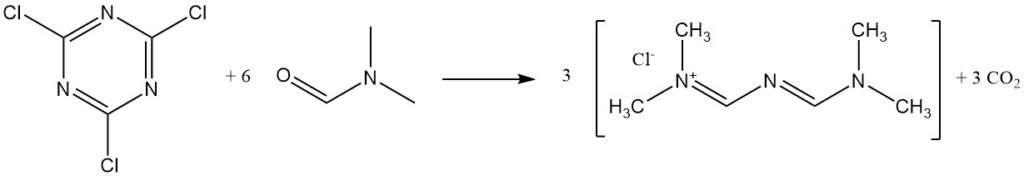
Cyanuurchloride reageert met DMF om Gold’s zout te vormen.
3. Productie van cyanuurchloride
Cyanuurchlorideproductiefaciliteiten bevinden zich doorgaans in de buurt van waterstofcyanide (HCN)-fabrieken, de primaire grondstof. Natriumcyanide kan ook worden gebruikt, maar in mindere mate.
Het productieproces van cyanuurchloride omvat twee hoofdstappen: chlorering van HCN tot cyanogeenchloride (ClCN) en trimerisatie van ClCN tot cyanuurchloride.
Eerst reageert HCN met chloor (Cl2) in een lusreactor bij gematigde temperaturen tussen 20 en 40 °C om ClCN te vormen. Deze reactie is exotherm (ΔH = -89 kJ/mol).
Vervolgens wordt het ClCN gescheiden, gezuiverd en vervolgens getrimeriseerd (drie moleculen in één gecombineerd) op actieve kool bij temperaturen boven 300 °C. Deze stap is ook exotherm (ΔH = -233 kJ/mol).
Figuur 1 illustreert een gedetailleerd proces voor de productie van cyanuurchloride uit chloor en blauwzuur.
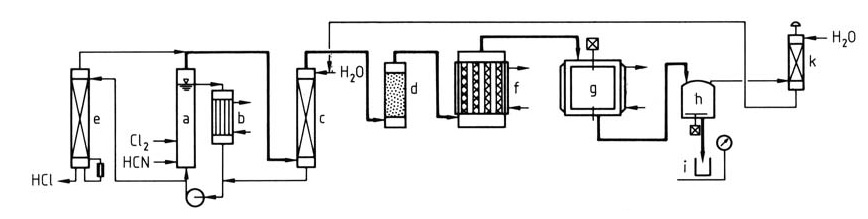
a) ClCN-reactor; b) Warmtewisselaar; c) Scrubber; d) Droger; e) Effluentstripper; f) Trimerisator; g) Condensor; h) Opslag; i) Trommel; k) Restgaswasser
Een mengsel van HCN en Cl2 wordt in de lusreactor (a & b) gevoerd. De verzadigde waterige oplossing van ClCN verlaat de lus, waarna het ClCN met water (c) wordt gewassen om onzuiverheden te verwijderen en wordt gedroogd (d).
Het waswater met HCl wordt naar een stripper (e) gestuurd om het opgeloste ClCN te winnen en geconcentreerde HCl vrij te geven voor verder gebruik. Als alternatief kunnen secties (e), (a) en (c) worden gecombineerd tot één eenheid. Het gezuiverde, droge ClCN ondergaat trimerisatie (f) op actieve kool om cyanuurchloridedampen te vormen.
De dampen worden gecondenseerd tot gesmolten of vast cyanuurchloride (g). Het product kan worden opgelost in een oplosmiddel voor gebruik in eigen beheer of worden verpakt in containers (h & i). Restgassen worden gewassen en gerecycled (k) om afval te minimaliseren.
Dit proces bereikt doorgaans ClCN-opbrengsten van meer dan 95% en cyanuurchloride-opbrengsten van meer dan 90%.
Verschillende variaties zijn gericht op het elimineren van verdunde HCl-vorming tijdens de productie van ClCN. Deze omvatten gasfasereacties in één stap met behulp van houtskool, tetrachloorethaan of cyanogeen en chloor op houtskool.
Andere katalysatoren voor ClCN-trimerisatie, zoals gefuseerd cyanuurchloride, metaalchloriden, eutectische mengsels en zeolieten, zijn onderzocht.
In laboratoria kunnen ClCN-oplossingen in organische oplosmiddelen zoals benzeen en chloroform worden getrimeriseerd met behulp van HCl. Commerciële processen kunnen de azeotroop waterstofchloride-dimethylether gebruiken voor trimerisatie.
Apparatuur voor ClCN-productie gebruikt materialen die bestand zijn tegen corrosie, zoals glas, fluorpolymeren, grafiet of speciale harsen. Apparatuur voor de productie van cyanuurchloride gebruikt doorgaans nikkel, roestvrij staal of aluminium.
Vocht is een belangrijk probleem bij dit proces en kan ernstige corrosie veroorzaken. De juiste apparatuur, materialen en behandelingsprocedures zijn belangrijk om dit risico te verminderen.
4. Toepassingen van cyanuurchloride
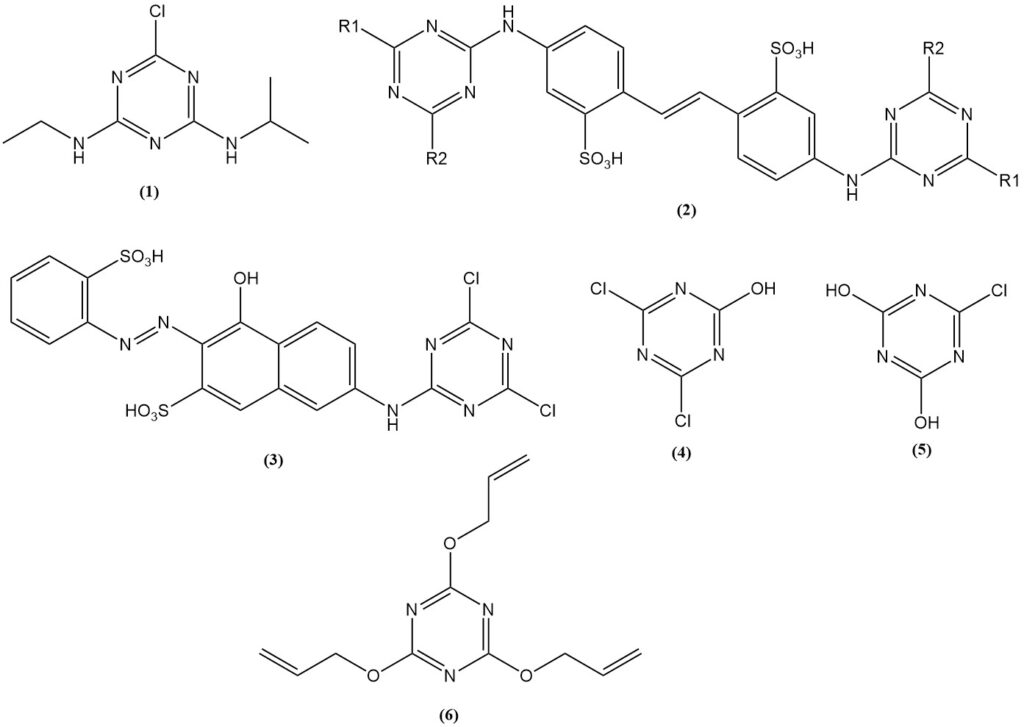
Cyanuurchloride wordt gebruikt als voorloper voor pesticiden en herbiciden, bij de productie van kleurstoffen, witmakers en UV-lichtstabilisatoren in kunststoffen en bij organische synthese.
De belangrijkste cyanuurchloridederivaten zijn aminotriazines, met name alkylaminotriazines, die worden gebruikt als pesticiden en herbiciden. Herbiciden op basis van triazine zijn nog steeds een van de meest succesvolle op commercieel gebied, waarbij de meeste formuleringen 2-chloor- of 2-methylthio-4,6-dialkylamino-1,3,5-triazines bevatten.
Atrazine (1) is het belangrijkste triazine-herbicide en is goed voor meer dan 70% van het verbruik van cyanuurchloride dat bestemd is voor de productie van herbiciden. Triazine-herbiciden worden wereldwijd geproduceerd.
Minder dan 30% van de productie van cyanuurchloride wordt gebruikt in andere industriële toepassingen, zoals optische witmakers, UV-stabilisatoren, reactieve kleurstoffen en cross-linking agents.
Reactieproducten van aminostilbenen met gesubstitueerde triazinen, met name bis(triazinylamino)stilbeendisulfonzuren (2), worden gebruikt als witmakers voor stoffen en papier.
Kleurstofderivaten bereid uit cyanuurchloride kunnen chemisch reageren met stoffen. De Procion-kleurstoffen (3) behoorden tot de eerste.
Cyanuurchloride en cyanuraten worden gebruikt bij de productie van gelatine en lijmen. Voorbeelden zijn natriumzouten van 2,4-dichloor-6-hydroxy-1,3,5-triazine (4) en 2,4-dihydroxy-6-chloor-1,3,5-triazine (5). Ook triallylcyanuraat (6) wordt gebruikt in de rubber- en kunststofindustrie.
Triazinen hebben verschillende andere toepassingen, waaronder als modificatoren, versnellers, vlamvertragers, farmaceutica, antioxidanten, antiozonanten en zware metaalvangers.
5. Toxicologie van cyanuurchloride
Cyanuurchloride is een ernstige irriterende stof voor de huid, slijmvliezen (inclusief de ogen), luchtwegen en het maag-darmkanaal. De irritatiedrempel van 1 minuut voor slijmvliezen is uitzonderlijk laag met 0,3 mg/m³. Allergische reacties kunnen ook optreden.
Direct contact met cyanuurchloride moet strikt worden vermeden. Zorg voor voldoende ventilatie in werkomgevingen.
Draag bij het hanteren van cyanuurchloridedamp of -stof een volgelaatsmasker met een actieve koolstofpatroon of gebruik een zelfstandig ademhalingsapparaat.
Cyanuurchloride is gemarkeerd met het gevarensymbool Xi en toegewezen aan risicozinnen (R-zinnen) R 36/37/38, wat duidt op irritatie van de ogen, luchtwegen en huid. Bovendien benadrukken veiligheidszinnen (S) 28 de noodzaak om geschikte beschermende kleding te dragen.
De volgende R- en S-zinnen moeten ook worden toegepast voor uitgebreide veiligheidslabels:
- R 22: Schadelijk bij inslikken
- R 26: Zeer giftig bij inademing
- R 41/43: Kan overgevoeligheid veroorzaken bij inademing en huidcontact
- S 36/37/39: Draag geschikte beschermende kleding, handschoenen en oog-/gezichtsbescherming
- S 45: Raadpleeg onmiddellijk een arts bij een ongeval of als u zich onwel voelt
Gebruik geaarde trechters om elektrostatische ontlading te voorkomen wanneer u cyanuurchloridepoeder toevoegt aan ontvlambare oplosmiddelen. Alleen gekwalificeerd personeel dat is opgeleid in de juiste verwerkingsprocedures, mag worden geautoriseerd om met cyanuurchloride te werken.
Referentie
- Cyanuric Acid and Cyanuric Chloride; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_191
