Titaandioxide: een compleet overzicht

Wat is titaandioxide?
Titaandioxide is een anorganische verbinding met de chemische formule TiO2. Het is een witte vaste stof die onoplosbaar is in water. Titaandioxide komt van nature voor als rutiel-, anataas- en brookietpolymorfen.
Rutiel en anataas worden industrieel gebruikt voor de productie van pigmenten, katalysatoren, keramiek en diverse andere technische materialen.
Titaandioxide is het belangrijkste witte pigment vanwege de uitzonderlijke verstrooiingseigenschappen, hoge chemische stabiliteit en niet-toxiciteit. In 2007 werd er ongeveer 5,0 miljoen ton titaandioxidepigmenten geproduceerd.
Titaandioxide behoort tot de vijf grootste anorganische chemicaliën qua economisch belang, met een wereldwijde jaarlijkse omzet van meer dan $ 12 miljard.
De productie van titaandioxide steeg van 1,389 miljoen ton in 1965 tot 3,220 miljoen ton in 1995. Het sulfaatproces domineerde de productie in het begin (90,3% in 1965), maar daalde tot 46,0% in 1995, toen het chlorideproces uitbreidde van 9,7% naar 54,0%. De productiecapaciteit bereikte 5,915 miljoen ton in 2008, waarbij het chlorideproces een lichte dominantie behield met 53,2%, tegenover het sulfaatproces met 46,8%.
Inhoudsopgave
1. Fysische eigenschappen van titaandioxide
Titaandioxide bestaat in drie kristalvormen: rutiel, anataas en brookiet. Rutiel is thermodynamisch het meest stabiel. Desondanks bezitten anataas en brookiet vergelijkbare roosterenergieën, wat bijdraagt aan hun stabiliteit op lange termijn. Anataas wordt onomkeerbaar omgezet in rutiel boven 700 °C. Brookiet kent beperkte industriële toepassingen vanwege de productiemoeilijkheden.
In alle drie de vormen van titaandioxide is elk titaanatoom octaëdrisch gecoördineerd door zes zuurstofatomen en elk zuurstofatoom trigonaal gecoördineerd door drie titaanatomen. De drie kristalstructuren corresponderen met verschillende manieren om de octaëders aan hun hoeken en randen te verbinden.
Tabel 1 geeft de kristalroosterconstanten en dichtheden van deze TiO2-modificaties weer.
Rutiel en anataas kristalliseren in het tetragonale systeem, terwijl brookiet kristalliseert in het rhombische systeem. Titaandioxide smelt bij ongeveer 1800 °C. Boven 1000 °C neemt de partiële zuurstofdruk toe door zuurstofvrijgave en de vorming van lagere titaanoxiden. Dit proces induceert kleurveranderingen en verandert de elektrische geleidbaarheid. Een reversibele gele kleuring ontstaat boven 400 °C door thermische roosteruitzetting.
Rutiel vertoont de hoogste dichtheid en atomaire pakking, wat resulteert in een superieure hardheid (Mohs 6,5-7,0) in vergelijking met anataas (Mohs 5,5-6,0). Additieven kunnen de hardheid van deze materialen in praktische toepassingen aanzienlijk beïnvloeden.
De hoge brekingsindex in combinatie met minimale absorptie van het zichtbare spectrum maakt titaandioxide tot een uitzonderlijk wit pigment. De gemiddelde brekingsindex is 2,55 voor anataas en 2,80 voor rutiel, die golflengteafhankelijk zijn.
Titaandioxide is een lichtgevoelige halfgeleider die elektromagnetische straling in de buurt van UV absorbeert. De band gap-energie die het energieverschil tussen de valentie- en geleidingsband weergeeft, is 3,03 eV voor rutiel en 3,15 eV voor anataas, wat overeenkomt met absorptieranden bij respectievelijk 415 nm en 385 nm.
Gebaseerd op het buigpunt van de absorptiecurve zijn deze waarden 3,13 eV (397 nm) voor rutiel en 3,29 eV (377 nm) voor anataas. Sporenverontreinigingen, zoals deeltjes per miljoen ijzer, kunnen absorptie van zichtbaar licht veroorzaken en leiden tot een afwijking van zuiver wit.
Absorptie van lichtenergie exciteert een elektron van de valentieband naar de geleidingsband. Het resulterende mobiele elektron en elektrongat kunnen migreren naar het oppervlak van de vaste stof, waar ze kunnen deelnemen aan redoxreacties.
| Fase | CAS-registratienummer | Kristalsysteem | Roosterconstanten, nm | Dichtheid, g/cm3 |
|---|---|---|---|---|
| Rutiel | [1317-80-2] | tetragonaal | a = 0,4594, c = 0,2958 | 4,21 |
| Anataas | [1317-70-0] | tetragonaal | a = 0,3785, c = 0,9514 | 4,06 |
| Brookite | [12188-41-9] | rhombisch | a = 0,9184, b = 0,5447, c = 0,5145 | 4,13 |
2. Chemische eigenschappen van titaandioxide
Titaandioxide vertoont amfotere eigenschappen met zwak zure en basische eigenschappen. Daarom zijn alkalimetaaltitanaten en vrije titaanzuren instabiel in waterige omgevingen en ondergaan ze hydrolyse om amorfe titaanoxidehydroxiden te vormen.
Titaandioxide is chemisch zeer stabiel en reageert niet met de meeste organische en anorganische reagentia. Oplossen vindt plaats in geconcentreerd zwavelzuur bij langdurige verhitting en in waterstoffluoride. Gesmolten alkalische en zure stoffen tasten het ook aan en lossen het op.
Bij verhoogde temperaturen reageert TiO2 met reductiemiddelen zoals koolmonoxide, waterstof en ammoniak om titaanoxiden met een lagere valentie te produceren zonder de vorming van metallisch titanium. Boven 500 °C reageert titaandioxide met chloor in aanwezigheid van koolstof om titaantetrachloride te vormen.
3. Oppervlakte-eigenschappen van titaandioxidepigmenten
Commercieel titaandioxide heeft een specifiek oppervlak van 0,5 tot >300 m²/g, afhankelijk van de toepassing. Standaardpigmenten hebben een oppervlak van 5-30 m²/g.
Een titaandioxideoppervlak is van nature bedekt met coördinatief gebonden water om hydroxylgroepen te vormen, waardoor het oppervlak van ongecoat titaandioxide polair wordt. Hydroxyloppervlaktebedekking beïnvloedt pigmenteigenschappen zoals dispergeerbaarheid en weersbestendigheid.
De aanwezigheid van deze hydroxylgroepen op het oppervlak maakt verschillende fotochemische reacties mogelijk, zoals de fotokatalytische ontleding van water tot waterstof en zuurstof en de reductie van stikstof tot ammoniak en hydrazine.
4. Industriële productie van titaandioxide
Commercieel titaandioxide wordt voornamelijk geproduceerd met behulp van twee verschillende industriële methoden: het sulfaatproces en het chlorideproces. Beide methoden zijn ontworpen om titaandioxidepigmenten te vormen.
Het sulfaatproces is een oudere techniek die begint met het laten reageren van titaniumrijke grondstoffen, zoals ilmeniet, met geconcentreerd zwavelzuur bij hoge temperaturen (150–220 °C). Deze reactie creëert een oplossing die titaan, ijzer en andere onzuiverheden bevat. Door middel van daaropvolgende stappen, zoals hydrolyse en zuivering, wordt een titaanoxidehydraat neergeslagen. Dit hydraat wordt vervolgens gecalcineerd (verhit tot hoge temperaturen), gemalen en vaak gecoat om het uiteindelijke pigment te verkrijgen.
Het chlorideproces omvat het chloreren van titaniumhoudende grondstoffen zoals ilmeniet of rutiel bij nog hogere temperaturen (700–1200 °C). Dit produceert titaniumtetrachloride (TiCl4), dat vervolgens wordt geoxideerd bij 900–1400 °C tot titaniumdioxide. Net als bij het sulfaatproces wordt het resulterende TiO2 vervolgens gemalen en gecoat.
Het is vermeldenswaard dat, hoewel deze twee processen de pigmentproductie domineren, er andere gespecialiseerde methoden bestaan voor de productie van titaniumdioxide zonder pigmenteigenschappen, met name voor de synthese van nanodeeltjes. Deze alternatieve methoden omvatten technieken zoals de hydrolyse van titaniumalcoholaten of de pyrolytische reactie van titaniumtetrachloride met water.
4.1. Productie van titaandioxide via het sulfaatproces
Het sulfaatproces voor de productie van titaandioxide omvat een reeks stappen, te beginnen met het vermalen van titaniumhoudende grondstoffen tot een fijn poeder (minder dan 40 μm) na droging. Dit wordt gevolgd door vertering, waarbij het gemalen materiaal bij hoge temperaturen (tot 220 °C) wordt gemengd met geconcentreerd zwavelzuur (80-98%), wat resulteert in een vaste verteringsmassa.
Deze vaste massa wordt vervolgens opgelost en gereduceerd in koud water of verdund zuur tot een titaandioxide-oplossing, waarbij driewaardig ijzer wordt gereduceerd tot tweewaardig ijzer om verontreiniging te voorkomen. Vervolgens ondergaat de oplossing een klaring om alle onopgeloste vaste stoffen te verwijderen door bezinking en filtratie. Voor oplossingen afgeleid van ilmeniet wordt ijzersulfaat gekristalliseerd door afkoeling om de concentratie te verlagen.
De belangrijkste stap is hydrolyse, waarbij titaanoxidehydraat bij 94-110 °C uit de oplossing wordt neergeslagen, vaak met behulp van kernen om de deeltjeseigenschappen te sturen. Dit hydrolysaat wordt vervolgens gezuiverd door reductie (bleken) met middelen zoals zink- of aluminiumpoeder om resterende gekleurde onzuiverheden te verwijderen, gevolgd door een tweede filtratie en wassing.
Vóór de laatste verwarmingsstap wordt het hydraat gedoteerd met alkalimetaalverbindingen en fosforzuur, en soms rutielkernen en stabilisatoren, om specifieke pigmenteigenschappen te verkrijgen.
Ten slotte wordt het gedoteerde hydraat gecalcineerd in draaiovens bij 800-1100 °C om water en resterend zwavelzuur te verwijderen en het hydraat om te zetten in kristallijn titaandioxide. De resulterende klinker wordt vervolgens gemalen (nat of droog) om de gewenste pigmentfijnheid te bereiken.
4.2. Productie van titaandioxide door middel van het chlorideproces
Het chlorideproces voor de productie van titaandioxidepigment begint met chlorering, waarbij titaniumhoudende grondstoffen en petroleumcokes in een wervelbedreactor bij hoge temperaturen (800–1200 °C) met chloor en zuurstof reageren om titaantetrachloride (TiCl4) te produceren.
De resulterende hete reactiegassen worden gekoeld, eerst om andere vaste chloriden en stof van het TiCl4 te scheiden en vervolgens om het grootste deel van het titaantetrachloride te condenseren door het te koelen tot onder 0 °C.
Het gecondenseerde TiCl4 wordt vervolgens gezuiverd door destillatie om vaste chloriden en opgeloste onzuiverheden zoals chloor, vanadiumtetrachloride en fosgeen te verwijderen om een titaantetrachlorideproduct met een hoge zuiverheid te garanderen.
Ten slotte wordt de gezuiverde TiCl4-damp verhit en in een speciaal ontworpen reactor bij zeer hoge temperaturen (900–1400 °C) omgezet met voorverwarmde zuurstof. Deze reactie produceert titaandioxidepigment en chloorgas.
Het TiO2-pigment wordt vervolgens uit de gasstroom gescheiden en het chloorgas wordt vaak teruggevoerd naar de chloreringsstap. De kwaliteit van het pigment (deeltjesgrootte en -verdeling) wordt zorgvuldig gecontroleerd door factoren zoals de reactietemperatuur en de toevoeging van specifieke verbindingen.
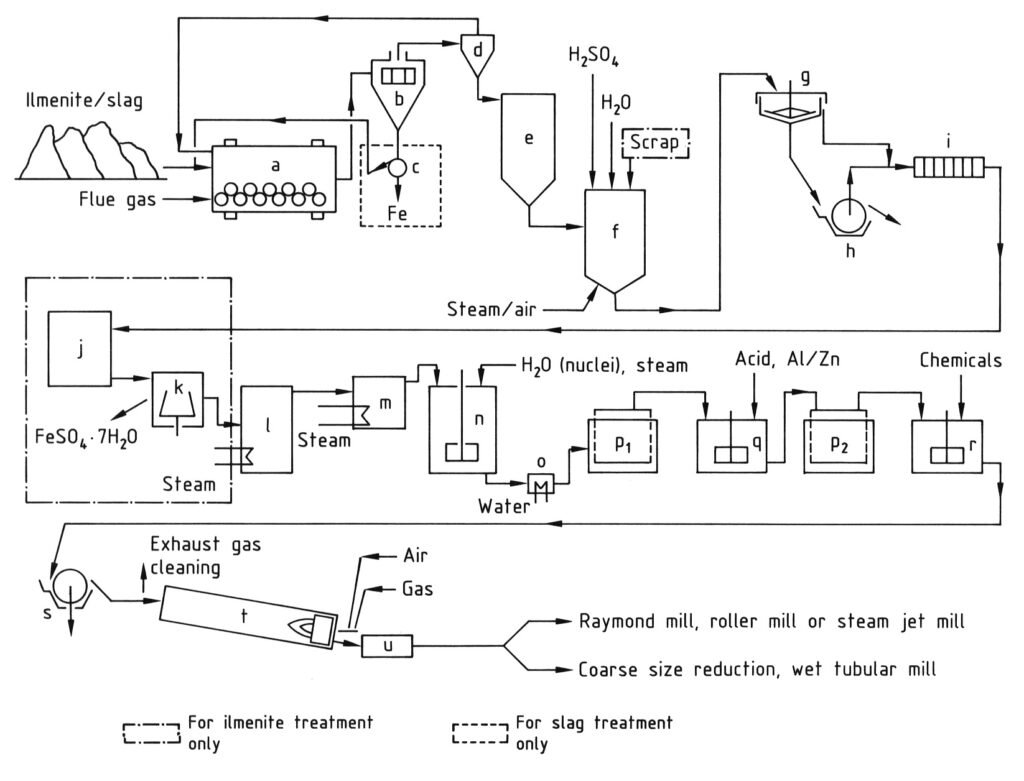
a) Kogelmolen/droger; b) Zeef; c) Magnetische scheider; d) Cycloon; e) Silo; f) Verteringsvat; g) Verdikkingsmiddel; h) Rotatiefilter; i) Filterpers; j) Kristallisatie-inrichting; k) Centrifuge; l) Vacuümverdamper; m) Voorverwarmer; n) Roertank voor hydrolyse; o) Koeler; p) Moore-filters; q) Roertank voor bleken; r) Roertank voor doperen; s) Rotatiefilter voor ontwatering; t) Draaioven; u) Koeler
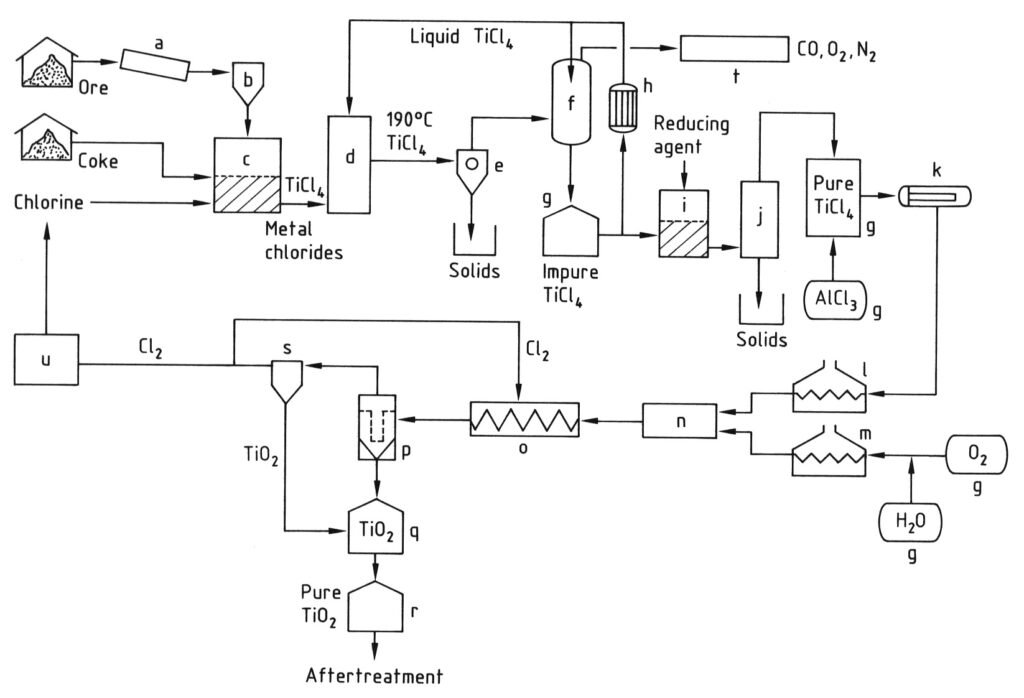
a) Molen; b) Silo; c) Reactor met gefluïdiseerd bed; d) Koeltoren; e) Scheiding van metaalchloriden; f) TiCl4-condensatie; g) Tank; h) Koeler; i) Vanadiumreductie; j) Destillatie; k) Verdamper; l) TiCl4-oververhitter; m) O2-oververhitter; n) Brander; o) Koelspiraal; p) Filter; q) TiO2-zuivering; r) Silo; s) Gaszuivering; t) Afgasreiniging; u) Cl2-liquefactie
5. Pigmenteigenschappen van titaandioxide
De belangrijke pigmenteigenschappen van titaandioxide zijn onder andere verstrooiingsvermogen, dekvermogen, helderheid, masstone, glansvorming, glanswaas, dispergeerbaarheid, lichtechtheid en weersbestendigheid. Deze eigenschappen zijn afhankelijk van de chemische zuiverheid, roosterstabilisatie, deeltjesgrootteverdeling en oppervlaktecoatings. Bij de evaluatie van de eigenschappen moet rekening worden gehouden met de interacties tussen pigment en matrix.
5.1. Verstrooiingsvermogen
De brekingsindices van rutiel (n = 2,80) en anataas (n = 2,55) zijn zelfs hoger dan die van diamant (n = 2,42). Relatieve brekingscoëfficiënten variëren doorgaans van 1,5 tot 2,0 voor verschillende bindmiddelsystemen.
Volgens de theorie van Mie vindt optimale verstrooiing plaats bij een deeltjesgrootte van 0,2 μm. Het verstrooiingsvermogen is afhankelijk van de golflengte; kleinere deeltjes titaandioxide verstrooien blauwe ondertonen en grotere deeltjes verstrooien gele ondertonen.
5.2. Masstone en kleur
De witheid van titaandioxide hangt af van de zuiverheid, kristallijne modificatie en deeltjesgrootte. Anatasepigmenten hebben een minder gele ondertoon dan rutielpigmenten omdat hun absorptieband (385 nm) naar het UV-gebied is verschoven.
De aanwezigheid van onzuiverheden in overgangselementen beïnvloedt de witheid. Daarom hebben de pigmenten van het chlorideproces een superieure kleurzuiverheid, omdat de TiCl4 vóór oxidatie door destillatie wordt gezuiverd.
5.3. Dispersie
Effectieve desintegratie en dispersie van titaandioxidepigmenten zijn essentieel voor het bereiken van een hoge glans en het minimaliseren van glanswaas. Dit wordt bereikt door intensief slijpen en organische oppervlaktecoating. De keuze van de oppervlaktebehandeling hangt af van de toepassingsvereisten.
5.4. Lichtechtheid en weersbestendigheid
De verwering van verven en coatings die titaandioxide bevatten, leidt tot verkrijting van pigmenten. Afwezigheid van zuurstof of een lage zuurstofdoorlaatbaarheid in bindmiddelen (bijv. melamine-formaldehydeharsen) voorkomt verkrijting, maar veroorzaakt reversibele vergrijzing. Vergrijzing wordt aanzienlijk verminderd bij afwezigheid van water.
Anataas is gevoeliger voor beide effecten. Pigmentfabrikanten gebruiken stabilisatiemethoden, zoals dopering met zink of aluminium vóór calcinatie of tijdens oxidatie.
In aanwezigheid van een stabiel bindmiddel fungeren titaandioxidepigmenten als fotokatalysatoren en veroorzaken ze degradatie van het bindmiddel. Bij bindmiddelen met een lage stabiliteit beschermen ze het bindmiddel tegen degradatie. Duurzaamheidstesten vereisen daarom zeer stabiele bindmiddelsystemen.
Het degradatiemechanisme volgt een cyclus van vijf stappen:
- Wateradsorptie vormt hydroxylgroepen aan het oppervlak.
- Absorptie van kortgolvig licht (anatase <385 nm, rutiel <415 nm) genereert een elektron en een elektrongat (exciton) in het kristalrooster, die naar het pigmentoppervlak migreren.
- Aan het oppervlak wordt een OH–-ion door het elektrongat geoxideerd tot een OH•-radicaal. Dit OH•-radicaal desorbeert en kan het bindmiddel oxidatief afbreken. Tegelijkertijd wordt Ti4+ door het resterende elektron gereduceerd tot Ti3+.
- Het Ti3+-ion wordt geoxideerd door geadsorbeerde zuurstof tot een O2–-ion, dat reageert met H+ tot een HO2•-radicaal.
- De cyclus eindigt met de binding van water aan het geregenereerde TiO2-oppervlak.
Kortom, het krijtproces is de reactie van water en zuurstof tot OH•– en HO2•-radicalen onder invloed van kortgolvige straling en de katalytische activiteit van het titaniumdioxide-oppervlak.
Deze cyclus kan worden onderbroken door uitsluiting van lucht of water. Zuurstofuitsluiting of snelheidsbeperkende zuurstofdiffusie in het bindmiddel leidt tot ophoping van Ti3+-ionen en vergrijzing, wat weer ongedaan wordt gemaakt bij geleidelijke blootstelling aan zuurstof. Wateruitsluiting voorkomt rehydratatie en de vorming van hydroxylgroepen aan het oppervlak.
Ondanks deze fotochemische activiteit stabiliseren behandelde rutielpigmenten veel bindmiddelen door lichtpenetratie in de coatinglagen te voorkomen. Hoogwaardige TiO2-pigmenten moeten een uitstekende weersbestendigheid hebben, zoals het weerstaan van aanzienlijke verkrijting of glansverslechtering na een tweejarige test in Florida.
5.5. Schuurvermogen
Schuurvermogen is een ongewenste eigenschap van titaandioxidepigmenten. Anatase heeft een lager schuurvermogen (Mohs 5,5-6,0) vergeleken met rutiel (Mohs 6,5-7,0). Hoewel deze intrinsieke hardheidswaarden vergelijkbaar lijken, beïnvloeden dopingadditieven de praktische hardheid aanzienlijk.
Zo hebben met aluminiumoxide gedoteerde rutielpigmenten een aanzienlijk hogere abrasiviteit dan anataaspigmenten zonder aluminiumoxide. Pigmenten uit het chlorideproces, die doorgaans meer aluminiumoxide bevatten, vertonen vaak een hogere abrasiviteit dan sulfaatpigmenten.
Dit fenomeen wordt toegeschreven aan de segregatie van acceptorionen zoals Al2O3 naar het oppervlak tijdens calcinatie, zelfs bij lage concentraties (<0,4%). Daarom vereisen studies naar de oppervlaktetopologie en roosterparameters van titaandioxide materialen met een zeer hoge zuiverheidsgraad om verkeerde interpretaties te voorkomen.
6. Toepassingen van pigmentvormig titaandioxide
Titaandioxide heeft een universele acceptatie bereikt en heeft andere witte pigmenten bijna volledig vervangen. In 2007 was Azië de grootste verbruiker, gevolgd door Europa en Noord-Amerika. Rutiel vormt ongeveer 90% van de totale consumptie en anataas 10%.
6.1. Toepassingen in verven en coatings
Verven en coatings zijn de grootste afnemers van titaandioxide. Het TiO2-pigment verbetert de beschermende eigenschappen van coatingmaterialen. Moderne TiO2-pigmenten kunnen dunne coatings vormen (enkele micrometers) voor volledige dekking van het substraat. De pigmentvolumeconcentraties variëren van 10% tot 35% in glanzende verven en kunnen meer dan 80% bedragen in matte dispersieverven.
Commerciële pigmenten maken verfproductie mogelijk met behulp van eenvoudige dispersieapparatuur zoals schijfoplossers. Organische behandeling vóór micronisatie met stoomstraal verbetert de glanseigenschappen en vermindert glanswaas in moffellakken. Sedimentatie treedt niet op tijdens de opslag van deze producten en ze beschikken over een goede lichtechtheid en weersbestendigheid.
6.2. Toepassingen in drukinkten
Moderne druktechnieken werken met laagdiktes van minder dan 10 μm, waarvoor de fijnst mogelijke titaandioxidepigmenten nodig zijn. Deze ultradunne films zijn alleen mogelijk met TiO2-pigmenten met een zeven keer zo sterk oplichtend (reducerend) vermogen als lithopoon.
Een uitzonderlijke dispergeerbaarheid is essentieel voor het bereiken van glans. De neutrale massa van titaandioxide maakt het bijzonder geschikt voor het oplichten van gekleurde pigmenten.
6.3. Toepassingen in kunststoffen
Titaandioxide wordt veelvuldig gebruikt voor het kleuren van zowel duurzame als niet-duurzame kunststofproducten, waaronder speelgoed, apparaten, auto’s, meubels en verpakkingsfolies. TiO2-pigmenten absorberen uv-straling onder 415 nm; daarom worden ze gebruikt om gepigmenteerde kunststoffen te beschermen tegen schadelijke straling.
Zelfs een minimale hoeveelheid titaandioxide geeft kunststoffen een ondoorzichtige uitstraling. Daarom wordt het toegevoegd aan donkergekleurde producten om een doorschijnende, “smoezelige” uitstraling te voorkomen.
6.4. Toepassingen in vezels
Titaandioxidepigmenten geven synthetische vezels een solide uitstraling door de doorschijnende eigenschappen en de bijbehorende vettige uitstraling te elimineren. Anatasepigmenten hebben in deze toepassing de voorkeur vanwege hun lagere schurende effect op spinapparatuur in vergelijking met rutiel. Een geschikte coating kan de slechte lichtechtheid van anataaspigmenten in polyamidevezels vergroten.
6.5. Toepassingen in papier
In Europa worden vulstoffen zoals kaolien, krijt of talk vaak gebruikt voor het oplichten en opacificeren van papier. Titaandioxidepigmenten zijn ideaal voor papier met een hoge witheid dat opaciteit vereist bij zeer dunne diktes (bijv. luchtpost- of dun printpapier).
TiO2 kan aan de papierpulp worden toegevoegd of als coating worden aangebracht voor superieure kwaliteit “kunstpapier”. Gelamineerd papier wordt doorgaans gekleurd met extreem lichtechte rutielpigmenten voordat het wordt geïmpregneerd met melamine-ureumhars voor decoratieve lagen of films.
6.6. Aanvullende toepassingen
Titaandioxidepigmenten worden gebruikt in de email- en keramiekindustrie, de productie van wit cement en het kleuren van rubber en linoleum. Daarnaast worden ze gebruikt als uv-absorberend materiaal in zonnebrandcrèmes, zeep, cosmetische poeders, crèmes, tandpasta en sigarenpapier.
Titaandioxide wordt ook gebruikt als kleurstof voor levensmiddelen en in de cosmetica-industrie in het algemeen vanwege zijn eigenschappen zoals niet-toxisch (orale inname), compatibiliteit met huid en slijmvliezen en goede dispergeerbaarheid in diverse oplossingen en bindmiddelen.
Elektrisch geleidende TiO2-pigmenten worden geproduceerd door oppervlaktebehandelingen met indium-tin- of antimoon-tin-mengoxidecoatings. Deze pigmenten worden gebruikt in vezels voor elektrofotografisch papier en bij de productie van antistatische kunststoffen.
7. Toepassingen van niet-pigmenthoudend titaandioxide

Niet-pigmentair TiO2 wordt gebruikt in emaille, glas en glaskeramiek, elektrokeramiek, katalysatoren en katalysatordragers, lasvloeimiddelen, gekleurde pigmenten, elektrische geleiders, chemische tussenproducten (bijv. kaliumfluorotitanaat), structurele keramiek, UV-absorbers en vuurvaste bekledingen.
7.1. Elektrokeramiek
Titanaten (bijv. barium-, strontium-, calcium- en loodtitanaat), gesynthetiseerd uit zeer zuivere titaniumdioxidesubstraten, worden gebruikt bij de productie van condensatoren, PTC-weerstanden en piëzo-elektrische materialen.
De eisen aan TiO2-uitgangsmaterialen met betrekking tot zuiverheid, reactiviteit en sintereigenschappen worden strenger vanwege de miniaturisatietrend in elektronische componenten, waardoor dunnere keramische lagen en kleinere deeltjes noodzakelijk zijn.
Recente ontwikkelingen met behulp van titaniumoxidehydraat (uit het sulfaatproces) hebben de vaste-toestandproductie van ultrazuiver, ultrafijn BaTiO3 mogelijk gemaakt onder 500 °C.
Piëzokeramische meerlaagse componenten, zoals actuatoren voor brandstofinjectiesystemen, vereisen keramiek met een lage sinteringssnelheid. Zeer reactieve TiO2– en ZrO2-componenten voor loodzirconaattitanaat (PZT) vergemakkelijken de vorming van perovskietstructuren en het daaropvolgende sinteren bij temperaturen die laag genoeg zijn om het dure palladiumgehalte in de elektroden van deze actuatoren aanzienlijk te verlagen.
Het wereldwijde verbruik van titaniumdioxide voor elektrokeramiek bedraagt meer dan 10.000 ton/jaar. Ondanks het effect van miniaturisatie van elektrokeramische componenten, wat resulteert in minder benodigde grondstoffen per elektronisch onderdeel, kan een aanhoudende jaarlijkse groei worden verwacht.
7.2. Katalysatoren
Titaandioxide wordt gebruikt als actieve katalysator voor diverse thermische en fotochemische reacties, waarbij zowel anorganische als organische verbindingen betrokken zijn. Het kan zelfdragend zijn of op andere materialen worden afgezet. Dopering met extra elementen versterkt doorgaans het gewenste katalytische effect.
De belangrijkste katalytische toepassing van titaandioxide is de verwijdering van stikstofoxide uit industriële afgassen (energiecentrales, verbrandingsinstallaties en dieselmotoren van auto’s). In dit proces, selectieve katalytische reductie (SCR) genoemd, reageren stikstofoxiden met ammoniak in aanwezigheid van zuurstof boven de katalysator om stikstof en water te produceren.
Het wereldwijde verbruik van titaandioxide voor SCR-katalysatoren bedraagt ongeveer 25.000 ton/jaar. Deze katalysatoren bevatten doorgaans tot 15% wolfraamoxide en ongeveer 1% V2O5 naast TiO2. Methoden voor de productie van katalysatoren omvatten extrusie in honingraatvorm, coating op substraten (bijv. cordieriet) of het aanbrengen van lagen op metalen platen.
Er gelden strenge eisen voor zuiverheid, deeltjesgrootte en porositeit om een aanhoudende katalytische activiteit gedurende een lange levensduur te garanderen. Er wordt een toenemende vraag naar stikstofoxideverwijdering uit stationaire en mobiele dieselmotoren verwacht.
Talrijke andere katalytische toepassingen maken gebruik van zuiver TiO2, TiO2 met toegevoegde additieven, of TiO2 met oppervlakteafgezette metalen (bijv. Rh, Pt, Pd, Au, Ag).
7.3. Fotokatalysatoren
Uitgebreid wereldwijd onderzoek richt zich op het benutten van de fotoactiviteit van onbehandelde of behandelde titaniumdioxide-nanodeeltjes. Titaniumdioxide kan worden gebruikt voor de katalytische afbraak van organische verbindingen in afvalwater of voor fotokatalytische luchtzuivering.
Zuivere TiO2-fotokatalyse vereist UV-straling vanwege de halfgeleiderbandafstand van ongeveer 3,1 eV, waardoor het alleen wordt gebruikt voor buitentoepassingen. Dopering van titaandioxide met metalen, koolstof of stikstof maakt echter fotokatalytische reacties mogelijk met behulp van het zichtbare deel van het spectrum. De stralingsintensiteit kan echter een beperkende factor zijn, zelfs voor toepassingen met zichtbaar licht.
Voorbeelden van recente fotokatalytische toepassingen zijn zelfreinigende architecturale (buiten)coatings, binnencoatings voor de afbraak van luchtverontreinigende stoffen in gebouwen, en vloertegels, coatings of beton met nanogestructureerd titaandioxide voor de afbraak van stikstofoxide in stedelijke gebieden.
Deze technologieën zijn beperkt tot gespecialiseerde toepassingen, zoals ziekenhuizen of locaties van specifiek openbaar belang.
7.4. Pigmenten van gemengde metaaloxides
Anataaspigmenten, of titaandioxidehydrolysaten, worden gecalcineerd met overgangsmetaaloxiden om chroomrutiel- of nikkelrutielpigmenten (pigmenten van gemengde metaaloxides) te vormen.
7.5. UV-absorptie
Nanogestructureerde TiO2-deeltjes (5–50 nm) worden verwerkt in zonnebrandcrèmes voor de cosmetische industrie en in UV-beschermende coatings (bijvoorbeeld voor hout). Meestal worden nanogestructureerde rutieldeeltjes met anorganische en optioneel organische coatings gebruikt.
Nanogroot titaandioxide lijkt transparant; het absorbeert effectief UV-B (280–320 nm) en UV-A (320–400 nm) straling. Door hun kleine deeltjesgrootte vereisen deze nanogestructureerde titaandioxidedeeltjes meer anorganische of organische coating in vergelijking met pigment TiO2.
7.6. Andere toepassingen
Niet-pigmentair titaandioxide wordt ook gebruikt in batterijen, brandstofcellen, watersplitsing en fotovoltaïsche systemen. Batterijen op basis van lithiumtitanaat winnen aan populariteit als oplaadbare energieopslagsystemen voor diverse toepassingen.
Hoewel de TiO2-gebaseerde fotovoltaïsche systemen (Grätzel-cellen) goed begrepen worden, vereist de toepassing van titaandioxide in brandstofcellen en voor fotokatalytische waterstofproductie uit water met behulp van zonlicht nog veel onderzoek.
8. Toxicologie van titaandioxide
Titaandioxide vertoont een goede stabiliteit en is volledig niet-toxisch bij orale toediening. Langdurige dierstudies met TiO2 in de voeding laten geen bewijs zien voor titaanopname.
De absorptie van fijnverdeelde titaandioxidepigmenten in de longen werd historisch gezien niet geassocieerd met specifieke carcinogene effecten. Daarom classificeerde het Internationaal Agentschap voor Kankeronderzoek (IARC) titaandioxide aanvankelijk als een stof van klasse 3, wat betekent dat het “niet classificeerbaar was wat betreft kankerverwekkendheid voor mensen”.
In 2007 herclassificeerde het IARC TiO2 echter als een stof van klasse 2B, wat aangeeft dat het “mogelijk kankerverwekkend is voor mensen”. Deze classificatie geldt zowel voor pigmentkwaliteit titaandioxide (primaire deeltjesgrootte 200-300 nm) als voor ultrafijne deeltjes (primaire deeltjesgrootte kleiner dan 50 nm).
Ondanks deze herclassificatie hebben epidemiologische studies naar blootstelling aan titaandioxidestof bij werknemers geen verhoogde mortaliteit of incidentie van longkanker aangetoond.
Referenties
- Auer, G., Woditsch, P., Westerhaus, A., Kischkewitz, J., Griebler, W.-d., Rohe, M. and Liedekerke, M. (2017). Pigments, Inorganic, 2. White Pigments. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.n20_n01.pub2
- Kang, X.; Liu, S.; Dai, Z.; He, Y.; Song, X.; Tan, Z. “Titanium Dioxide: From Engineering to Applications.” Catalysts, 2019, 9 (2), 191. DOI: 10.3390/catal9020191.
- Haider, A. J.; Jameel, Z. N.; Al-Hussaini, I. H. M. “Review on: Titanium Dioxide Applications.” Energy Procedia, 2019, 157, 17-29. DOI: 10.1016/j.egypro.2018.11.159.
- Fujishima, A.; Rao, T. N.; Tryk, D. A. “Titanium dioxide photocatalysis.” Journal of Photochemistry and Photobiology C: Photochemistry Reviews, 2000, 1 (1), 1-21. DOI: 10.1016/S1389-5567(00)00002-2.
- Diebold, U. “The surface science of titanium dioxide.” Surface Science Reports, 2003, 48 (5–8), 53-229. DOI: 10.1016/S0167-5729(02)00100-0.
- Chen, X.; Mao, S. S. “Titanium Dioxide Nanomaterials: Synthesis, Properties, Modifications, and Applications.” Chem. Rev., 2007, 107 (7), 2891–2959. DOI: 10.1021/cr0500535.
- Racovita, A. D. “Titanium Dioxide: Structure, Impact, and Toxicity.” Int. J. Environ. Res. Public Health, 2022, 19 (9), 5681. DOI: 10.3390/ijerph19095681.
- Weir, A.; Westerhoff, P.; Fabricius, L.; Hristovski, K.; von Goetz, N. “Titanium Dioxide Nanoparticles in Food and Personal Care Products.” Environ. Sci. Technol., 2012, 46 (4), 2242–2250. DOI: 10.1021/es204168d.
- Ghamarpoor, R.; Fallah, A.; Jamshidi, M. “Investigating the use of titanium dioxide (TiO2) nanoparticles on the amount of protection against UV irradiation.” Sci Rep, 2023, 13, 9793. DOI: 10.1038/s41598-023-37057-5.
- Middlemas, S.; Fang, Z. Z.; Fan, P. “A new method for production of titanium dioxide pigment.” Hydrometallurgy, 2013, 131–132, 107-113. DOI: 10.1016/j.hydromet.2012.11.002.
- Gázquez, M.; Bolívar, J.; Garcia-Tenorio, R.; Vaca, F. “A Review of the Production Cycle of Titanium Dioxide Pigment.” Materials Sciences and Applications, 2014, 5, 441-458. DOI: 10.4236/msa.2014.57048.
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. “Titanium Dioxide.” In Some Organic Solvents, Resin Monomers and Related Compounds, Pigments and Occupational Exposures in Paint Manufacture and Painting; IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, No. 47; International Agency for Research on Cancer: Lyon (FR), 1989. Available from: https://www.ncbi.nlm.nih.gov/books/NBK524874/.
- Goparaju, V. R. R.; Marshall, D. F.; Kazerooni, V. “Process for manufacturing titanium dioxide pigments using ultrasonication.” U.S. Patent 9,353,266, 2016. Available from: https://patents.google.com/patent/US9353266B2/en.
- Davis, B. R.; Rahm, J. A. “Process for manufacturing titanium dioxide.” U.S. Patent 4,288,418, 1981. Available from: https://patents.google.com/patent/US4288418A/en.
- Ayorinde, T.; Sayes, C. M. “An updated review of industrially relevant titanium dioxide and its environmental health effects.” J. Hazard. Mater. Lett., 2023, 4, 100085. DOI: 10.1016/j.hazl.2023.100085.
