Sulfaminezuur: eigenschappen, reacties, productie en toepassingen
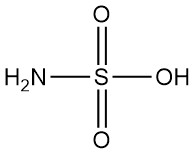
Wat is sulfaminezuur?
Sulfaminezuur, ook bekend als amidozwavelzuur, is een sterk anorganisch zuur met de chemische formule H3NSO3. Het is een witte, geurloze, kristallijne en niet-hygroscopische vaste stof die sterk dissocieert in water.
Sulfaminezuur wordt al ongeveer een halve eeuw industrieel geproduceerd. In de periode van 1950 tot 1980 werden productiefaciliteiten opgezet in meerdere geïndustrialiseerde landen in afwachting van een toegenomen vraag op de markt.
De daaropvolgende dalingen in de productvraag, samen met productie-uitdagingen en moeilijkheden met betrekking tot de verwijdering van bijproducten, leidden echter tot de sluiting van alle productiefaciliteiten in Europa en de Verenigde Staten. De productie gaat door in Japan (Nissan) en in Taiwan (meerdere fabrikanten).
Inhoudsopgave
1. Fysische eigenschappen van sulfaminezuur
Sulfaminezuur is een witte, kristallijne en niet-vluchtige vaste stof bij kamertemperatuur. Het vormt een sterk zure waterige oplossing met een pH van 1,18 voor slechts 1% oplossing. De oplosbaarheid van sulfaminezuur in water wordt verhoogd door andere zuren of zouten toe te voegen en vertoont een beperkte oplosbaarheid in geconcentreerde anorganische zuren en de meeste organische oplosmiddelen.
De oplosbaarheid in water is afhankelijk van de temperatuur, zoals gedetailleerd in Tabel 1.
| Temperatuur (°C) | Oplosbaarheid (g/100 g) | Concentratie (wt %) |
|---|---|---|
| 0 | 14,7 | 12,8 |
| 10 | 18,5 | 15,6 |
| 20 | 21,3 | 17,5 |
| 30 | 26,1 | 20,7 |
| 40 | 29,5 | 22,8 |
| 50 | 32,8 | 24,7 |
| 60 | 37,1 | 27,0 |
| 70 | 41,9 | 29,5 |
| 80 | 47,0 | 32.0 |
Belangrijke fysische eigenschappen van sulfaminezuur worden in de onderstaande tabel weergegeven.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [5329-14-6] |
| Chemische formule | H3NSO3 |
| Moleculair gewicht | 97,1 g/mol |
| Smeltpunt | 205 °C |
| Dissociatieconstante | 1,10 x 10-1 |
| Dichtheid bij 25 °C | 2,126 g/cm3 |
| Soortelijke warmte | 1,1467 J/g |
| Dampspanning bij 20 °C | 0,8 Pa |
| Dampspanning bij 100 °C | 0,25 Pa |
2. Chemische reacties van sulfaminezuur
Door sulfaminezuur boven 209 °C te verhitten, ontleedt het in zwaveltrioxide, zwaveldioxide, water, ammoniak en stikstof.
Waterige sulfaminezuuroplossingen hydrolyseren tot ammoniumwaterstofsulfaat:
NH2SO3H + H2O → NH4HSO4
De hydrolysesnelheid is afhankelijk van de concentratie, pH en temperatuur. Verdunde waterige oplossingen zijn stabiel bij omgevingstemperatuur. Een 10% oplossing van sulfaminezuur wordt gehydrolyseerd tot 50% bij een temperatuur van 80 °C gedurende 10 uur.
Sulfaamzuur kan worden geoxideerd in aanwezigheid van chloor, broom en chloraten om zwavelzuur te produceren.
2 NH2SO3H + KClO3 → 2 H2SO4 + N2 + KCl + H2O
Door geconcentreerd salpeterzuur te verhitten met sulfaminezuur, wordt distikstofoxide gevormd.
NH2SO3H + HNO3 → H2SO4 + N2O + H2O
Salpeterigzuur reageert volledig met sulfaminezuur om stikstof en zwavelzuur te produceren, dus deze reactie kan worden gebruikt voor kwantitatieve analyse.
NH2SO3H + HNO2 → H2SO4 + H2O + N2
Reactie met thionylchloride resulteert in de vorming van sulfamylchloride:
NH2SO3H + SOCl2 → ClSO2NH2 + SO2 + HCl
Sulfaminezuur lost metaalhydroxiden, -oxiden en -carbonaten op.
Primaire en secundaire alcoholen reageren met sulfaminezuur om alkylammoniumsulfaten te vormen.
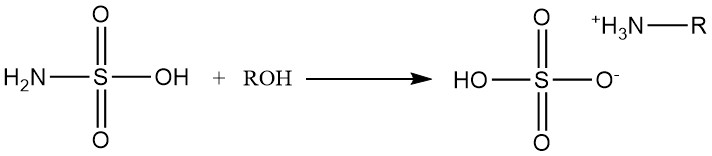
Secundaire alcoholreacties vereisen de aanwezigheid van aminekatalysatoren, en tertiaire alcoholen reageren niet met sulfaminezuur.
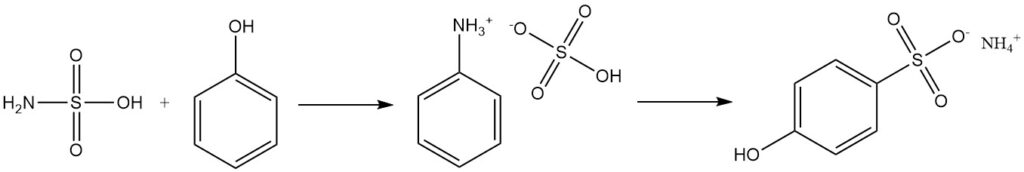
Aromatische alcoholen zoals fenol reageren met sulfaminezuur om sulfonaten te produceren, met fenylammoniumsulfaat als tussenproduct.
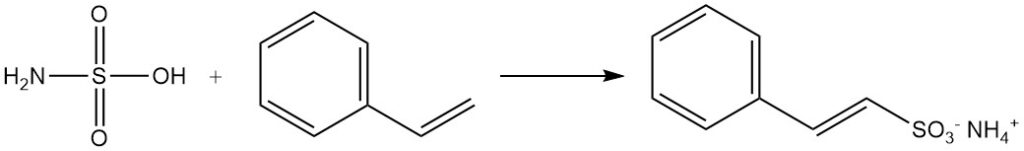
Aldehyden vormen additieproducten met sulfaminezuurzouten. Aromatische verbindingen met onverzadigde zijketens, zoals styreen, ondergaan sulfonering door sulfaminezuur terwijl de dubbele binding van de zijketen behouden blijft.
3. Productie van sulfaminezuur
De productie van sulfaminezuur maakt uitsluitend gebruik van het ureumproces, waarbij fabrieken die ammoniak en zwaveltrioxide gebruiken, hun activiteiten hebben gestaakt.
Sulfaminezuur wordt rechtstreeks geproduceerd door equimolaire hoeveelheden ureum, zwaveltrioxide en zwavelzuur te laten reageren.
NH2CONH2 + SO3 + H2SO4 → 2 NH2SO3H + CO2
Deze reactie is sterk exotherm en omvat een proces in twee fasen, volgens de volgende reacties:
NH2CONH2 + SO3 → NH2CONHSO3H
NH2CONHSO3H + H2SO4 → 2 NH2SO3H + CO2
In de beginfase wordt ureum geroerd met overtollig zwavelzuur en zwaveltrioxide. De temperatuur wordt onder de 40 °C gehouden om de vorming van koolstofdioxide te remmen. De tweede fase omvat het laten reageren van het product uit de eerste fase in aanwezigheid van overtollig zwaveltrioxide bij een temperatuurbereik van 50–80 °C om sulfaminezuur en koolstofdioxide te verkrijgen.
Na het verwijderen van overtollig zwaveltrioxide wordt sulfaminezuur met een zuiverheid van meer dan 95% verkregen en wordt een product met een hoge zuiverheid verkregen door herkristallisatie.
Volgens een Nissan-patent wordt sulfaminezuur geproduceerd door ureum te laten reageren met oleum (xH2SO4 · ySO3).
Het reactieproduct wordt nat geherkristalliseerd, gevolgd door scheiding en droging van het gekristalliseerde zuur. Hogedrukmaling met een druk variërend van 600–1500 kg/m2 resulteert in een fijn kristallijn product met een gemiddelde deeltjesdiameter van ≤ 500 μm.
4. Toepassingen van sulfaminezuur
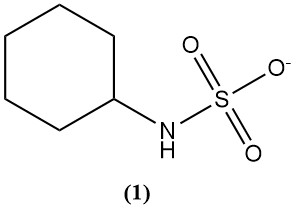
Sulfaminezuur wordt voornamelijk gebruikt om cyclamaat (1) te synthetiseren, wat een kunstmatige zoetstof is.
Sulfaamzuur wordt ook gebruikt in schoonmaakproducten om carbonaat- en fosfaatafzettingen, zoals ketelsteen, te verwijderen vanwege het vermogen om oplosbare zouten te vormen en de relatief lage corrosiviteit ten opzichte van metalen.
Het wordt gebruikt bij het reinigen van machines en instrumenten in sectoren zoals papier, suiker, zuivel en brouwerijen, evenals bij het verwijderen van afzettingen in verdampingsinstallaties, warmtewisselaars en koelsystemen.
Bepaalde landen gebruiken sulfaminezuur om vet- of geëthoxyleerde alcoholen te behandelen in een proces op industriële schaal om wasprecursoren te produceren.
Sulfaamzuur wordt ook gebruikt als chloorstabilisator, bij de productie van kleurstoffen, bij galvaniseringsprocessen en in de papier- en textielindustrie.
In laboratoria wordt het gebruikt in de analytische chemie.
5. Toxicologie van sulfaminezuur
Sulfaminezuur wordt over het algemeen beschouwd als een lage toxiciteit. De fysiologische eigenschappen zijn kenmerkend voor een sterk mineraalzuur.
Sulfaamzuurstof kan de slijmvliezen van de neus en keelholte irriteren, evenals het bindvlies van de ogen. Dit is een veelvoorkomend effect van veel sterke zuren.
Orale toediening van 1,6 g/kg sulfaminezuur aan ratten is dodelijk gebleken. Dit duidt op een bepaald niveau van toxiciteit, maar het is essentieel om te overwegen dat dit een relatief hoge dosis is en dat de studie is uitgevoerd op ratten. De menselijke toxiciteit kan verschillen.
Sulfaamzuur is, net als andere sterke zuren, corrosief voor de huid, ogen en luchtwegen. Direct contact moet worden vermeden.
Correcte verwerkingsprocedures, inclusief het gebruik van persoonlijke beschermingsmiddelen (PBM) zoals handschoenen, een veiligheidsbril en ademhalingsbescherming, zijn essentieel bij het werken met sulfaminezuur.
Referentie
- Sulfamic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a25_439
