Acetamide: eigenschappen, productie en toepassingen

Wat is acetamide?
Acetamide, ook bekend als ethaanamide of azijnzuuramide, is een organische verbinding met de chemische formule C2H5NO. Het is een witte, geurloze, hygroscopische vaste stof die wordt gevormd uit azijnzuur en ammoniak. Acetamide wordt van nature aangetroffen in de wortels van suikerbieten en in stortplaatsen van kolenmijnen als een klein bijproduct van de afbraak van organisch materiaal.
Inhoudsopgave
1. Fysische eigenschappen van acetamide
Zuivere acetamide heeft een bittere smaak en is geurloos. Een karakteristieke muisachtige geur wordt toegeschreven aan sporen van onzuiverheden, mogelijk afkomstig van acetonitril. Acetamide komt voor in twee kristalvormen: een stabiele trigonale vorm en een metastabiele orthorombische modificatie. Het is zeer goed oplosbaar in water, ethanol, chloroform, glycerine en hete benzeen en slecht oplosbaar in di-ethylether.
Tabel 1 geeft een overzicht van de belangrijkste fysische eigenschappen van acetamide.
| Eigenschap | Waarde |
|---|---|
| CAS-registratienummer | 60-35-5 |
| Molecuulformule | C2H5NO |
| Molaire massa | 59,07 g·mol−1 |
| Smeltpunt | 81–82 °C |
| Smeltpunt (trigonaal) | 80,0–80,1 °C |
| Tripelpunt | 353,33 K |
| Kookpunt (1 atm) | ≈221 °C |
| Dichtheid (20 °C) | ≈1,16 g/cm3 |
| Smeltdichtheid bij 85 °C | 0,9986 g·mL−1 |
| Smeltwarmte (ΔHm) | 264 kJ·kg−1 |
| Diëlektrische constante | 59 |
| Dipoolmoment | 12,41 × 10−30 C·m |
| Dampspanning bij 272 K | 10 kPa |
| Dampdruk bij 278 K | 20 kPa |
| Dampdruk bij 281 K | 30 kPa |
| Dampdruk bij 284 K | 40 kPa |
| Dampdruk bij 285 K | 50 kPa |
| Dampdruk bij 287 K | 60 kPa |
| Dampdruk bij 288 K | 70 kPa |
| Dampdruk bij 290 K | 80 kPa |
| Dampdruk bij 291 K | 90 kPa |
| Dampdruk bij 292 K | 100 kPa |
2. Chemische eigenschappen van aceetamide
Aceetamide is een eenvoudig alifatisch amide en vertoont eigenschappen die kenmerkend zijn voor de amidefunctie.
Aceetamide vertoont amfoteer gedrag wanneer opgelost in water. Hydrolyse in neutraal water verloopt slechts langzaam, maar in aanwezigheid van sterke zuren of basen reageert het direct tot azijnzuur en ammoniak.
De autodissociatieconstante van aceetamide is ongeveer 3,2 × 10-11 bij 94 °C, wat wijst op een geringe neiging tot zelfionisatie onder thermische omstandigheden.
Aceetamide reageert met minerale zuren tot vaste complexen. Zouten van waterstofbromide, waterstofchloride en salpeterzuur met aceetamide zijn geïsoleerd en gekarakteriseerd.
De gesmolten fase van aceetamide wordt gebruikt om metaalzouten op te lossen die zijn beoordeeld op geleidbaarheid, stabiliteit en geschiktheid voor elektrodepositie.
3. Productie van aceetamide
Aceetamide wordt via verschillende synthetische routes verkregen. Het wordt industrieel geproduceerd door continue dehydratie van ammoniumacetaat, wat ook de standaard laboratoriummethode is.
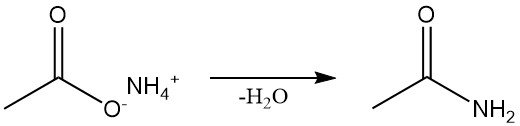
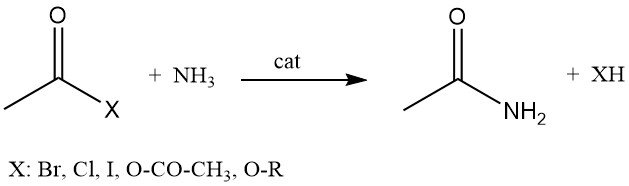
Acetamide kan ook worden geproduceerd door de reactie van acetylhalogeniden, azijnzuuranhydride of alkylacetaten met ammoniak.
Een alternatieve methode voor de productie van acetamide is de hydratatie van acetonitril in aanwezigheid van zure of basische katalysatoren. Dit proces wordt veel gebruikt omdat acetonitril als bijproduct ontstaat bij de productie van acrylonitril.
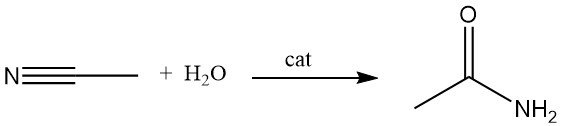
Kopergekatalyseerde hydratatie van acetonitril kan een conversie-efficiëntie tot 83% bereiken. Bepaalde micro-organismen kunnen deze reactie ook katalyseren bij kamertemperatuur.
4. Toepassingen van acetamide
Acetamide wordt gebruikt als oplosmiddel en als weekmaker. Het kent een breed scala aan toepassingen in diverse industrieën.
Acetamide remt de zuurvorming in drukinkten, lakken, explosieven en parfums. Het wordt gebruikt als milde vochtinbrenger en als weekmaker voor leer, textiel, papier en bepaalde kunststoffen.
Acetamide wordt ook gebruikt als tussenproduct bij de synthese van farmaceutische producten, pesticiden en anti-oxidanten voor kunststoffen. Derivaten van acetamide, waaronder gesubstitueerde acetamidehoudende thiourea, zijn onderzocht op hun antivirale werking tegen herpesvirussen.
Acetamide wordt toegepast als weekmaker en stabilisator bij de productie van polymeren. Het is onderzocht als cryoprotectief middel en als bestanddeel van smeermiddelen en brandwerende formules.
Bepaalde acetamidederivaten worden in landbouwstudies toegepast als modificatoren van het voedingsgedrag.
In laboratoriumonderzoek wordt acetamide vaak gebruikt als modelverbinding voor het bestuderen van de structurele en waterstofbindende eigenschappen van amiden.
5. Toxicologie van acetamide
Acetamide is gebruikt als bron van niet-eiwitstikstof bij herkauwers, zoals schapen en melkvee. Voedingsniveaus van ongeveer 2-3% lijken niet-toxisch. Het bufferen van het dieet met dibasische zuren zorgt voor een hogere inname door het wegvangen van ammoniak dat vrijkomt tijdens de spijsvertering.
Het Internationaal Agentschap voor Kankeronderzoek (IARC) classificeert acetamide als mogelijk carcinogeen voor de mens (Groep 2B).
Chronische orale blootstelling bij ratten toonde hepatocarcinogeniciteit aan: toediening gedurende 1 jaar van 2,36% acetamide in het dieet leidde tot leverkanker. Aanvullende studies hebben hepatotoxische en hematopoëtische effecten aangetoond.
Het precieze mechanisme van de toxiciteit van acetamide blijft onduidelijk. Het profiel verschilt van dat van dimethylacetamide en lijkt verband te houden met de vorming van hydroxylamine uit de primaire metaboliet, acetohydroxaminezuur.
Acetamide vertoont geen ontwikkelingstoxiciteit. Reproductiestudies bij knaagdieren hebben geen veranderingen in de spermatogenese, hormonale veranderingen of schade aan de bijbehorende voortplantingsorganen aangetoond.
Bij muizen leidde orale toediening van acetamide tot goedaardige en kwaadaardige levertumoren. Mannelijke muizen vertoonden ook een verhoogde incidentie van kwaadaardige lymfomen. Over het algemeen ondersteunen deze bevindingen de classificatie van acetamide als hepatocarcinogeen bij knaagdieren met mogelijk carcinogeen potentieel bij mensen.
Referenties
1. Wagner, F.S., Jr. (2002). Acetamide. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a02.pub2
2. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
3. Mohammadi, S.; Foroumadi, A. Acetamide. In *Encyclopedia of Toxicology*, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 39–42. DOI: 10.1016/B978-0-12-824315-2.01089-7
